
【题目】在四个不同的容器中进行合成氨的反应。根据下列在相同时间内测定的结果,判断生成氨的速率最快的是
A.v(H2)=0.06mol·L-1·s-1B.v(N2)=0.1mol·L-1·min-1
C.v(N2)=0.2mol·L-1·min-1D.v(NH3)=0.3mol·L-1·min-1
 学练快车道口算心算速算天天练系列答案
学练快车道口算心算速算天天练系列答案科目:高中化学 来源: 题型:
【题目】某Na2CO3和NaHCO3的混合溶液,取该溶液50.00mL加水稀释到1L。
(1)从稀释后溶液中取出20.00mL.测量溶液体积的仪器事先进行洗涤的洗涤液依次为:自来水、_____、_____,对溶液体积读数的方法是读出_____对应的刻度值。
(2)稀释后溶液用标准盐酸(0.2000mol/L)进行滴定:
①取20.00mL溶液(酚酞做指示剂)消耗标准盐酸12.00mL。
②取10.00mL(甲基橙做指示剂)消耗标准盐酸15.00mL。
判断①滴定终点的现象是_____。则此次测定原样品溶液中碳酸氢钠的浓度_____。
(3)重复上述(2)滴定操作1﹣2次的目的是_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在药物制剂中,抗氧剂与被保护的药物在与![]() 发生反应时具有竞争性,抗氧性强弱主要取决于其氧化反应的速率。
发生反应时具有竞争性,抗氧性强弱主要取决于其氧化反应的速率。![]() 、
、![]() 和
和![]() 是三种常用的抗氧剂。下列说法中,不正确的是
是三种常用的抗氧剂。下列说法中,不正确的是
已知:![]() 溶于水发生反应:
溶于水发生反应:![]()
实验用品 | 实验操作和现象 |
① ② ③ | 实验1:溶液①使紫色石蕊溶液变蓝,溶液②使之变红。 实验2:溶液①与 实验3:调溶液①②③的pH相同,保持体系中 |

A.![]() 溶液显碱性,原因是:
溶液显碱性,原因是:![]()
B.![]() 溶液中
溶液中![]() 的电离程度大于水解程度
的电离程度大于水解程度
C.实验2说明,![]() 在
在![]() 时抗氧性最强
时抗氧性最强
D.实验3中,三种溶液在pH相同时起抗氧作用的微粒种类和浓度相同,因此反应速率相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知下列热化学方程式:
(1)CH3COOH(l)+2O2(g)= 2CO2(g)+2H2O(l) ΔH1=-870.3 kJ/mol
(2)C(s)+O2(g)= CO2(g) ΔH2=-393.5 kJ/mol
(3)H2(g)+![]() O2(g)= H2O(l) ΔH3=-285.8 kJ/mol
O2(g)= H2O(l) ΔH3=-285.8 kJ/mol
则反应2C(s)+2H2(g)+O2(g)= CH3COOH(l)的焓变为( ).
A.-488.3 kJ/molB.-244.15 kJ/molC.488.3 kJ/molD.244.15 kJ/mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硼氢化物NaBH4(B元素的化合价为+3价)燃料电池(DBFC),由于具有比能量高、产物清洁无污染和燃料易于储存和运输等优点,被认为是一种很有发展潜力的燃料电池,其工作原理如图所示,下列说法正确的是
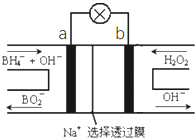
A.放电时,每转移2mol电子,理论上需要消耗9.5gNaBH4
B.电极a采用MnO2,MnO2既作电极材料又有催化作用
C.电池放电时Na+从b极区移向a极区
D.电池的负极反应为![]() +2H2O﹣8e-=
+2H2O﹣8e-=![]() +8H+
+8H+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】[化学一选修3:物质结构与性质
(1)Ti(BH4)3是一种储氢材料,可由TiCl4和LiBH4反应制得。
①基态Ti3+的未成对电子数有__________个。
②LiBH4由Li+和BH4-构成,BH4-的空间构型是__________,B原子的杂化轨道类型是_____。
③某储氢材料是第三周期金属元素M的氢化物,M的部分电离能如下表所示:
I1/kJ·mol-1 | I2/kJ·mol-1 | I3/kJ·mol-1 | I4/kJ·mol-1 | I5/kJ·mol-1 |
738 | 1451 | 7733 | 10540 | 13630 |
M是_______(填元素符号),判断理由为_______________。
(2)铜晶体中铜原子的堆积方式如图所示,铜晶体中原子的堆积模型属于____________。

(3)A原子的价电子排布式为3s23p5,铜与A 形成化合物的晶胞如图所示(黑点代表铜原子)。
①该晶体的化学式为______________。
②该化合物难溶于水但易溶于氨水,其原因是_____________ ,此化合物的氨水溶液遇到空气则被氧化为深蓝色,深蓝色溶液中阳离子的化学式为____________。
③己知该晶体的密度为ρg·cm-3,阿伏伽德罗常数为NA,己知该晶体中Cu原子和A原子之间的最短距离为体对角线的1/4,则该晶体中Cu原子和A原子之间的最短距离为________pm。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学兴趣小组为探究Cl2、Br2、Fe3+的氧化性强弱,设计了如下实验:
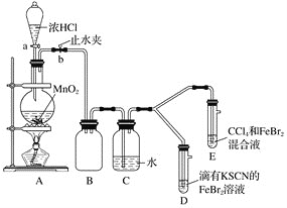
(1)①装置A中发生反应的离子方程式是____________________。
②整套实验装置存在一处明显的不足,请指出__________________。
(2)用改正后的装置进行实验,实验过程如下:_______。
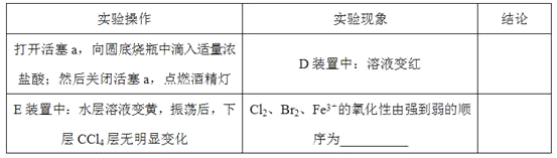
(3)因忙于观察和记录,没有及时停止反应,D、E中均发生了新的变化。D装置中:红色慢慢褪去。E装置中:CCl4层先由无色变为橙色,后颜色逐渐加深,直至变成红色。
为探究上述实验现象的本质,小组同学查得资料如下:
i.Fe3+3SCN-![]() Fe(SCN)3是一个可逆反应。
Fe(SCN)3是一个可逆反应。
ii.(SCN)2性质与卤素单质类似、氧化性:Cl2>(SCN)2。
iii.Cl2和Br2反应生辰BrCl,BrCl呈红色(略带黄色),沸点约5℃,它与水能发生水解反应,且该反应为非氧化还原反应。
iv.AgClO、AgBrO均可溶于水。
①用平衡移动原理(结合上述资料)解释Cl2过量时D中溶液红色褪去的原因_______,现设计简单实验证明上述解释:取少量褪色后的溶液,滴加___________溶液,若溶液颜色________,则上述解释是合理的。
②探究E中颜色变化的原因,设计实验如下:
用分液漏斗分离出E的下层溶液,蒸馏、收集红色物质,取少量,加入AgNO3溶液,结果观察到仅有白色沉淀产生。请结合上述资料用两步方程式(离子或化学方程式不限定)解释仅产生白色沉淀的原因:__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将一定量A、B装入容积为1 L的恒温密闭容器中,发生反应:2A(g)+mB(g)![]() nC(g),1 min时达到平衡,C的浓度为x mol·L-1。若保持温度不变,将密闭容器的容积压缩为原来的1/2,达到新的平衡时C的浓度为1.8x mol·L-1。下列说法正确的是( )
nC(g),1 min时达到平衡,C的浓度为x mol·L-1。若保持温度不变,将密闭容器的容积压缩为原来的1/2,达到新的平衡时C的浓度为1.8x mol·L-1。下列说法正确的是( )
A.化学计量数的关系为2+m <n
B.容器的容积缩小,正反应速率增大,逆反应速率减小
C.原容器中用B表示的该反应在1min内的平均速率为![]() mol·(L·min)-1
mol·(L·min)-1
D.若保持温度和容器容积不变,充入氦气,平衡向逆反应方向移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室可用氯气与金属铁反应制备无水三氯化铁,该化合物呈棕红色、易潮解,100℃左右时升华。下图是两个学生设计的实验装置,左边的反应装置相同,而右边的产品收集装置则不相同,分别如(I)和(Ⅱ)所示,
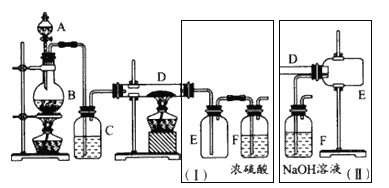
试回答:
(1)B中反应的化学方程式为___________________________。
(2)D中的反应开始前,需排除装置中的空气,应采取的方法是______________。
(3)D中反应的化学方程式为______________________________。
(4)装置(I)的主要缺点是_______________________。
(5)装置(Ⅱ)的主要缺点是______________________________,如果选用此装置来完成实验,则必须采取的改进措施是:___________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com