
| A. | 使甲基橙呈红色的溶液中:Fe2+、Na+、ClO-、SO42- | |
| B. | 在PH=3的溶液中:Mg2+、Al3+、NO3-、Cl- | |
| C. | 由水电离出的c(H+)=10-13mol•L-1的溶液中:Na+、SO32-、AlO2-、Br- | |
| D. | 加入铝粉后产生大量氢气的溶液中:NH4+、K+、NO3-、MnO4- |
分析 A.使甲基橙呈红色的溶液,显酸性;
B.PH=3的溶液,显酸性;
C.由水电离出的c(H+)=10-13mol•L-1的溶液,为酸或碱溶液;
D.加入铝粉后产生大量氢气的溶液,为非氧化性酸或强碱溶液.
解答 解:A.使甲基橙呈红色的溶液,显酸性,Fe2+、H+、ClO-发生氧化还原反应,不能共存,故A错误;
B.PH=3的溶液,显酸性,该组离子之间不反应,可大量共存,故B正确;
C.由水电离出的c(H+)=10-13mol•L-1的溶液,为酸或碱溶液,酸溶液中不能大量存在SO32-、AlO2-,故C错误;
D.加入铝粉后产生大量氢气的溶液,为非氧化性酸或强碱溶液,碱溶液中不能大量存在NH4+,酸溶液中H+、NO3-、Al发生氧化还原反应不生成氢气,故D错误;
故选B.
点评 本题考查离子的共存,为高频考点,把握习题中的信息及常见离子之间的反应为解答的关键,侧重复分解反应、氧化还原反应的离子共存考查,题目难度不大.


科目:高中化学 来源: 题型:填空题
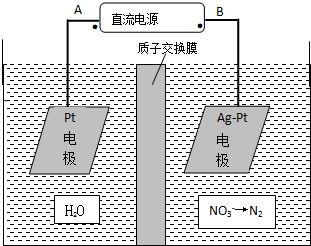 硝酸是一种重要的化工原料,工业上一般以氨气为原料来制备硝酸.请回答:
硝酸是一种重要的化工原料,工业上一般以氨气为原料来制备硝酸.请回答:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 A、B、C、D、E五种常见元素的核电荷数依次增大.A的基态原子中有2个未成对电子,B是地壳中含量最多的元素,C是短周期中最活泼的金属元素,D与C可形成CD型离子化合物,E的基态3d轨道上有2个电子.请回答下列问题:
A、B、C、D、E五种常见元素的核电荷数依次增大.A的基态原子中有2个未成对电子,B是地壳中含量最多的元素,C是短周期中最活泼的金属元素,D与C可形成CD型离子化合物,E的基态3d轨道上有2个电子.请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
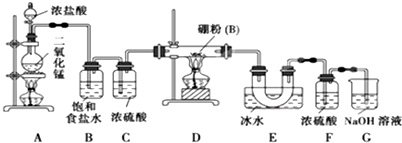
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 检验淀粉是否发生水解,将淀粉与稀硫酸溶液共热,冷却后,取上层水溶液,用NaOH中和稀硫酸后,再加入Cu(OH)2悬浊液,加热,观察是否产生砖红色沉淀 | |
| B. | 检验Fe(NO3)2晶体是否已氧化变质,将Fe(NO3)2样品溶于稀硫酸后,滴加KSCN溶液,观察溶液是否变血红色 | |
| C. | 在酸、碱中和滴定终点时不慎滴入过量标准溶液,可用装有待测液的滴定管再滴入一定量溶液进行调整 | |
| D. | 实验室制备氢氧化亚铁,滴加氢氧化钠溶液时应将胶头滴管插入硫酸亚铁溶液中 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
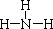 ,写出甲与足量的氢氧化钠溶液反应的化学方程式为AlN+NaOH+H2O=NaAlO2+NH3↑,验证溶液丁中产物阴离子的实验方法为取少量溶液丁于试管中,逐滴加入稀盐酸,若先产生白色沉淀后消失,说明为NaAlO2.
,写出甲与足量的氢氧化钠溶液反应的化学方程式为AlN+NaOH+H2O=NaAlO2+NH3↑,验证溶液丁中产物阴离子的实验方法为取少量溶液丁于试管中,逐滴加入稀盐酸,若先产生白色沉淀后消失,说明为NaAlO2.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 布洛芬具有解热镇痛作用,常规剂量使用时,不良反应发生率低,是国内外包括世界卫生组织公认的用于小儿发热的经典解热镇痛药.布洛芬的结构简式如图:
布洛芬具有解热镇痛作用,常规剂量使用时,不良反应发生率低,是国内外包括世界卫生组织公认的用于小儿发热的经典解热镇痛药.布洛芬的结构简式如图: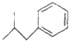 $→_{AlCl_{3}}^{CH_{3}COCl}$A$\stackrel{H_{2}}{→}$
$→_{AlCl_{3}}^{CH_{3}COCl}$A$\stackrel{H_{2}}{→}$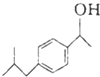 $\stackrel{CO}{→}$布洛芬
$\stackrel{CO}{→}$布洛芬 +
+ $\stackrel{AlCl_{3}}{→}$
$\stackrel{AlCl_{3}}{→}$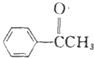 +HCl,请写出A的结构简式
+HCl,请写出A的结构简式

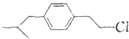 为原料合成布洛芬(用合成路线流程图表示;无机原料任选,并注明反应条件).
为原料合成布洛芬(用合成路线流程图表示;无机原料任选,并注明反应条件). .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 规律 | 结论 |
| A | 较强酸可以制取较弱酸 | H2S溶液无法制取H2SO4 |
| B | 反应物浓度越大,反应速率越快 | 常温下,相同的铝片中分别加入足量的浓、稀硝酸中,铁丝在浓硫酸中先反应完 |
| C | 离子反应总是向着某种离子浓度减小的方向进行 | 反应2Na+2CH3COOH═2Na++2CH3COO-+H2↑不能进行 |
| D | 溶解度小的沉淀易向溶解度更小的沉淀转化 | MgCO3沉淀在水中煮沸,最终转化为Mg(OH)2沉淀 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com