
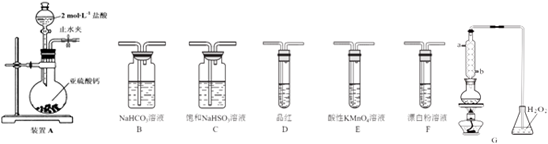
| A. | 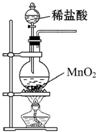 制取少量Cl2 | |
| B. | 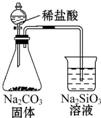 证明非金属性Cl>C>Si | |
| C. | 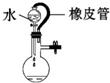 水不能持续流下,说明装置气密性良好 | |
| D. | 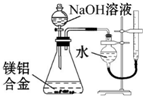 测定镁铝合金中铝的质量分数 |
分析 A.稀盐酸与二氧化锰不反应;
B.盐酸易挥发,盐酸与硅酸钠反应;
C.橡胶管可平衡气压,打开分液漏斗的活塞液体能顺利流下;
D.Al与NaOH溶液反应,而Mg不能,利用排水法测定氢气的体积.
解答 解:A.稀盐酸与二氧化锰不反应,则图中装置不能制备氯气,故A错误;
B.盐酸易挥发,盐酸与硅酸钠反应,则不能比较C、Si的非金属性,且不能利用盐酸、碳酸的酸性比较Cl、C的非金属性,故B错误;
C.橡胶管可平衡气压,打开分液漏斗的活塞液体能顺利流下,不能说明气密性,应利用液差法检验气密性,故C错误;
D.Al与NaOH溶液反应,而Mg不能,利用排水法测定氢气的体积,则图中装置可测定镁铝合金中铝的质量分数,故D正确;
故选D.
点评 本题考查化学实验方案的评价,为高频考点,把握气体的制备实验、非金属性比较、含量测定及气密性检验等为解答的关键,侧重分析与应用能力的考查,注意实验装置的作用及实验评价性分析,题目难度不大.


 一线名师权威作业本系列答案
一线名师权威作业本系列答案科目:高中化学 来源: 题型:选择题
| A. | 乙烯为纯净物;聚乙烯为混合物 | |
| B. | 等质量的乙烯和聚乙烯完全燃烧后,生成的CO2和H2O的质量分别相等 | |
| C. | 乙烯的化学性质比聚乙烯活泼 | |
| D. | 乙烯和聚乙烯都能使溴水褪色 |
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
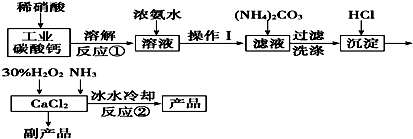
 硼及其化合物在工业上有许多用途.工业上以铁硼矿为原料制备硼酸,铁硼矿含有Mg、Fe、Ca、Al、B、O等多种元素,它的主要成分为Mg2B2O5•H2O和Fe3O4.
硼及其化合物在工业上有许多用途.工业上以铁硼矿为原料制备硼酸,铁硼矿含有Mg、Fe、Ca、Al、B、O等多种元素,它的主要成分为Mg2B2O5•H2O和Fe3O4.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com