
| W | 单质是淡黄色固体 |
| X | 在地壳中的含量居第二位 |
| Y | 原子最外层电子数是电子总数的$\frac{2}{3}$ |
| Z | 第三周期原子半径最小的金属元素 |
| A. | 气态氢化物的热稳定性:X>W | |
| B. | 最高价氧化物对应水化物的酸性:Y>X | |
| C. | 离子半径:Z>W | |
| D. | Z 的氧化物不具有两性 |
分析 W、X、Y、Z 是短周期元素,W单质是淡黄色固体,则W为S元素;X在地壳中的含量居第二位,则X为Si;Y原子最外层电子数是电子总数的$\frac{2}{3}$,最外层电子数不超过8,则Y原子核外电子数小于12,只能处于第二周期,设最外层电子数为a,则(2+a)×$\frac{2}{3}$=a,解得a=4,故Y为碳元素;Z是第三周期原子半径最小的金属元素,则Z为Al.
解答 解:W、X、Y、Z 是短周期元素,W单质是淡黄色固体,则W为S元素;X在地壳中的含量居第二位,则X为Si;Y原子最外层电子数是电子总数的$\frac{2}{3}$,最外层电子数不超过8,则Y原子核外电子数小于12,只能处于第二周期,设最外层电子数为a,则(2+a)×$\frac{2}{3}$=a,解得a=4,故Y为碳元素;Z是第三周期原子半径最小的金属元素,则Z为Al.
A.非金属性X(Si)<W(S),故气态氢化物的热稳定性:X<W,故A错误;
B.非金属性Y(碳)>X(Si),故最高价氧化物对应水化物的酸性:Y>X,故B正确;
C.Z、W的离子分别为Al3+、S2-,S2-比Al3+多一个电子层,故离子半径:S2->Al3+,故C错误;
D.Z 的氧化物是氧化铝,属于两性氧化物,故D错误.
故选:B.
点评 本题考查结构性质位置关系应用,侧重对元素周期律与元素化合物性质的考查,从结构上理解同周期、同主族元素性质的递变性与相似性.


科目:高中化学 来源: 题型:选择题
| A. | 等浓度的①(NH4)2SO4溶液、②NH4HCO3溶液、③NH4Cl溶液中的c(NH4+):①>③>② | |
| B. | 等体积pH=a的醋酸与pH=b的NaOH溶液(a+b=14)充分混合时,可能有:c(CH3COO-)>c(Na+)>c(H+)>c(OH-) | |
| C. | 已知Ka(HClO)=3.0×10-8,Ka(HCN)=6.2×10-10,等体积、等浓度的NaClO、NaCN溶液中,前者中的离子总数小于后者中的离子总数 | |
| D. | 向20mL氨水中加入10mL等浓度的盐酸,有c(NH4+)-c(NH3•H2O)=2[c(OH-)-c(H+)] |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
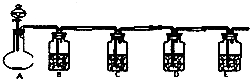 设计一实验将只含有Na2SO4、Na2SO3、Na2CO3的白色固体中的三种成分检验出来.取一定量的白色固体与烧瓶A中,通过分液漏斗加入液体a,如图所示:
设计一实验将只含有Na2SO4、Na2SO3、Na2CO3的白色固体中的三种成分检验出来.取一定量的白色固体与烧瓶A中,通过分液漏斗加入液体a,如图所示:查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 25℃时,pH=7的NH4Cl与NH3•H2O混合溶液中:c(H+)=c(OH-)<c(NH4+)=c(Cl-) | |
| B. | 将pH=3的醋酸溶液稀释后,溶液中所有离子的浓度均降低 | |
| C. | 向Na2CO3溶液中逐滴滴加稀盐酸时,溶液中c(HCO3-)的变化情况是先变小后变大 | |
| D. | 0.01 mol•L-1Na2CO3溶液与0.01 mol•L-1 NaHCO3溶液等体积混合:3c(CO32-)+3c(HCO3-)+3c(H2CO3)=2c(Na+) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 4种 | B. | 5种 | C. | 6种 | D. | 7种 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
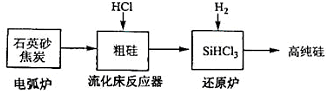
| 发生的主要反应 | |
| 电弧炉 | SiO2+2C$\stackrel{1600-1800℃}{?}$Si+2CO↑ |
| 流化床反器 | Si+3HCl$\stackrel{250-300℃}{?}$SiHCl3+H2 |
| 还原炉 | SiHCl3+H2$\stackrel{1100-1200℃}{?}$Si+3HCl |
| 物质 | Si | SiCl4 | SiHCl3 | SiH2Cl2 | SiH3Cl | HCl | SiH4 |
| 沸点/℃ | 2355 | 57.6 | 31.8 | 8.2 | -30.4 | -84.9 | -111.9 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 将FeCl2溶液在空气中加热蒸干并灼烧,最终得到黑色FeO固体 | |
| B. | 同浓度的氨水,NH4Cl、(NH4)2SO4溶液中水电离出氢离子浓度相同 | |
| C. | 一定浓度的氨水和盐酸混合存在关系:c(NH4+)+c(H+)=c(OH-)+c(Cl-) | |
| D. | 室温下,0.1mol/L的HA溶液中$\frac{c({H}^{+})}{c(O{H}^{-})}$=1010,则NaA溶液显酸性 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
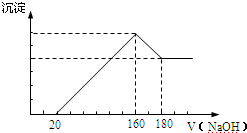
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
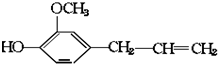 其可能具有的性质是( )
其可能具有的性质是( )| A. | ②③ | B. | ①②③④ | C. | ①②③④⑤ | D. | ①②③⑤⑥ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com