
| 8×2+2-8 |
| 2 |
| 8×2+2-8 |
| 2 |
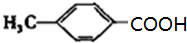 、
、 ,故答案为:4;
,故答案为:4; 、
、 ;
; 、
、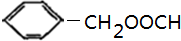 ,故答案为:6;
,故答案为:6; 、
、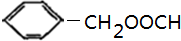 ;
; 、
、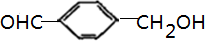 ,故答案为:4;
,故答案为:4; 、
、 .
.


 巧学巧练系列答案
巧学巧练系列答案 课课练江苏系列答案
课课练江苏系列答案科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
 某无色溶液中只含有下列离子中的某几种:Na+、Mg2+、SO42-、CO32-、Cl-、MnO4-.为了鉴别这些离子,分别取少量溶液进行以下实验:
某无色溶液中只含有下列离子中的某几种:Na+、Mg2+、SO42-、CO32-、Cl-、MnO4-.为了鉴别这些离子,分别取少量溶液进行以下实验:查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
 某兴趣小组设计如图微型实验装置.实验时,先断开K2,闭合K1,两极均有气泡产生;一段时间后,断开K1,闭合K2,发现电流表A指针偏转.
某兴趣小组设计如图微型实验装置.实验时,先断开K2,闭合K1,两极均有气泡产生;一段时间后,断开K1,闭合K2,发现电流表A指针偏转.查看答案和解析>>
科目:高中化学 来源: 题型:
| A、1mol/L |
| B、2mol/L |
| C、2.5mol/L |
| D、3mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、FeS2只作氧化剂 |
| B、被氧化的硫元素和被还原的硫元素的质量比为3:7 |
| C、生成7 mol Cu2S,有10 mol电子转移 |
| D、氧化剂与还原剂物质的量之比为14:5 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com