
【题目】生物体内某些有机物的元素组成可表示如下,据图回答:

(1)A的功能多样性是由A的__________多样性决定的,其中A3指的是__________,可以用__________试剂检测A物质,产生的颜色变化是__________。
(2)小分子a的名称为__________,结构通式为__________。
(3)B如果是主要的能源物质,则b是__________,在动物细胞中B有两种,分别是__________和__________。如果B是植物细胞壁的成分,则B是__________。
(4)小分子c的名称为__________,C1的中文名称为__________。
(5)与B物质有相同的元素组成,被称为细胞内良好储能物质的是__________,可用__________试剂检测,产生的颜色变化是__________。
【答案】结构 血红蛋白双缩脲紫色氨基酸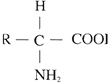 葡萄糖肝糖原肌糖原纤维素核苷酸脱氧核糖核酸脂肪苏丹Ⅲ(或苏丹Ⅳ)橘黄色(或红色)
葡萄糖肝糖原肌糖原纤维素核苷酸脱氧核糖核酸脂肪苏丹Ⅲ(或苏丹Ⅳ)橘黄色(或红色)
【解析】
本题以图文结合为情境,考查学生对细胞内的有机化合物(蛋白质、核酸、糖类、脂肪)的化学组成及功能等相关知识的识记和理解能力,以及获取信息、分析问题的能力。
(1) 分析图示可知:A为蛋白质,蛋白质功能的多样性是由其结构的多样性决定的,其中有运输氧气功能的A3是血红蛋白。蛋白质与双缩脲试剂发生作用产生紫色反应。
(2) 小分子a为氨基酸,其结构通式见答案。
(3) 由C、H、O三种元素组成的B如果是主要的能源物质,则B为多糖,小分子b是葡萄糖。动物细胞特有的多糖是糖原,有肝糖原和肌糖原两种。植物细胞的多糖主要是淀粉和纤维素,其中纤维素是植物细胞壁的主要组成成分之一。
(4) 由C、H、O、N、P五种元素组成的小分子c为核苷酸,C是核酸,其中C2所示的极少数病毒的遗传物质是RNA,则C1为DNA。DNA的中文名称为脱氧核糖核酸。
(5) 脂肪是细胞内良好储能物质。脂肪被苏丹Ⅲ染液染成橘黄色或被苏丹Ⅳ染液染成红色。


科目:高中化学 来源: 题型:
【题目】一定温度下,在一固定体积的密闭容器中,对于可逆反应:A(s)+3B(g) ![]() 2C(g),下列说法说明达到平衡状态的是( )
2C(g),下列说法说明达到平衡状态的是( )
①C的生成速率和C的分解速率相等;②单位时间内生成a mol A,同时生成3a mol B;③气体密度不再变化;④混合气体的总压强不再变化;⑤A、B、C的物质的量之比为1∶3∶2;⑥C的体积分数不再变化
A. ②④⑤ B. ①③④⑥
C. ①②④⑥ D. ①②③④⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,下列各组离子在相应的条件下可能大量共存的是( )
A. 能使pH试纸变红的溶液中:CO32-、K+、Cl-、Na+
B. 由水电离产生的c(OH-)=1×10-10mol·L-1的溶液中:NO3-、Mg2+、Na+、SO42-
C. 在![]() =1×10-12的溶液中:NH4+、Fe2+、Cl-、NO3-
=1×10-12的溶液中:NH4+、Fe2+、Cl-、NO3-
D. ![]() =10-10mol·L-1的溶液中:Na+、HCO3-、Cl-、K+
=10-10mol·L-1的溶液中:Na+、HCO3-、Cl-、K+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25 ℃时,Ksp(BaSO4)=1×10-10 mol2·L-2,Ksp(BaCO3)=5.1×10-9 mol2·L-2。在该温度下,下列说法不正确的是( )
A. 因为Ksp(BaCO3)>Ksp(BaSO4),所以BaSO4比BaCO3溶解度更小
B. 若误饮c(Ba2+)=1.0×10-5mol·L-1的溶液时,会引起Ba2+中毒
C. 向同浓度Na2SO4和Na2CO3的混合液中滴加BaCl2溶液,BaSO4先析出
D. 在BaSO4的饱和溶液液中,c(SO42-)=1.0×10-5mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有常温条件下甲、乙、丙三种溶液,甲为0.1 mol/L的NaOH溶液,乙为0.1 mol/L的HCl溶液,丙为0.1 mol/L的CH3COOH溶液,试回答下列问题:
(1)甲溶液的pH=__________;
(2)丙溶液中存在电离平衡为_____________、______________(用电离方程式表示);
(3)某同学用甲溶液分别滴定20.00 mL乙溶液和 20.00 mL丙溶液,得到如图所示两条滴定曲线,请完成有关问题:

①甲溶液滴定丙溶液的曲线是________(填“图1”或“图2”);
②a=________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学用托盘天平(配有1g、2g、5g等砝码)称取3.0gNaCl晶体,操作时将药品与砝码的位置放颠倒了,则实际称得的NaCl晶体的质量
A.大于3.0gB.小于30g
C.等于3.0gD.无法确定
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用相关知识填空.
(1)标准状况下11.2LNH3中含______个氨分子,含______mol氢原子.
(2)等质量的SO2和SO3物质的量之比是_______;所含的氧原子个数之比是______.
(3)4.8gCH4中所含氢原子数与______g水所含氢原子数相等.
(4)12.4gNa2R含Na+0.4mol,则Na2R的摩尔质量为______.
(5)标况下,一定量的N2与22.4LCO所含电子的物质的量相等,则N2的质量是______.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某生产工艺中用惰性电极电解Na2CO3溶液获得NaHCO3和NaOH,其原理如题21图。下列有关说法正确的是

A. a 接外电源负极
B. B出口为H2,C出口为NaHCO3溶液
C. 阳极电极反应为4CO32-+2H2O-4e- = 4HCO3-+O2↑
D. 应选用阳离子交换膜,电解时Na+从右侧往左移动
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com