
【题目】现有反应mA(g)+nB(g)![]() pC(g)+qD(g),达到平衡后,当升高温度时,B的转化率变大;当减小压强时,混合体系中C的质量分数也减小,则:
pC(g)+qD(g),达到平衡后,当升高温度时,B的转化率变大;当减小压强时,混合体系中C的质量分数也减小,则:
(1)该反应的逆反应是________热反应,且m+n______p+q(填“>”、“<”或“=”)。
(2)若加入催化剂,平衡时气体混合物的总物质的量________(填“增大”、“减小”或“不变”)。
(3)若B是有色物质,A、C、D均为无色物质,则加入C(体积不变)时混合物的颜色__________(填“变深”、“变浅”或“不变”),而维持容器内气体的压强不变,充入氖气时,平衡__________移动(填“向左”、“向右”、或“不”)。
科目:高中化学 来源: 题型:
【题目】实验室中,从海带里提取碘的部分流程如下图,下列说法不正确的是

A. 步骤①灼烧海带需要用坩埚
B. 步骤③主要操作为过滤
C. 步骤④主要反应为:2I-+H2O2+2H+=2H2O+I2
D. 步骤⑤可以加入酒精萃取I2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图装置所示,C、D、E、F、X、Y都是惰性电极,甲、乙中溶液的体积和浓度都相同(假设通电前后溶液体积不变),A、B为外接直流电源的两极。将直流电源接通后,F极附近呈红色。请回答:
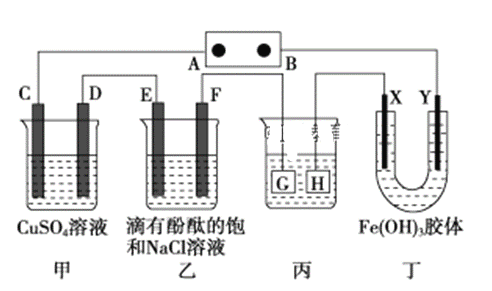
(1)B极是电源的________极,一段时间后,甲中溶液颜色________,丁中X极附近的颜色逐渐变浅,Y极附近的颜色逐渐变深,这表明氢氧化铁胶体粒子带___电荷(填“正”或“负”,在电场作用下向____极移动(填“X”或“Y”)。
(2)若甲、乙装置中的C、D、E、F电极均只有一种单质生成时,对应单质的物质的量之比为_________________。
(3)现用丙装置给铜件镀银,则H应该是________(填“镀层金属”或“镀件”),电镀液是________溶液。当乙中溶液的pH是13时(此时乙溶液体积为500 mL),丙中镀件上析出银的质量为________,甲中溶液的pH________(填“变大”“变小”或“不变”)。
(4)若将C电极换为铁,其他装置都不变,则甲中发生总反应的离子方程式是__________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】依据事实,书写下列热化学方程式:
(1)在25℃、101kPa时,1molC与1mol水蒸气反应生成1molCO和1molH2,吸热131.5kJ:______________________________________。
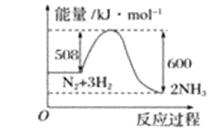
(2)根据下图写出热化学方程式__________________________________________。
(3)已知稀溶液中,1 mol H2SO4与NaOH溶液恰好完全反应时,放出114.6 kJ热量,写出表示H2SO4与NaOH反应中和热的热化学方程式__________________。
(4)已知:2SO2(g)+O2(g)![]() 2SO3(g) ΔH=-196.6 kJ·mol–1
2SO3(g) ΔH=-196.6 kJ·mol–1
2NO(g)+O2(g)![]() 2NO2(g) ΔH=-113.0 kJ·mol–1
2NO2(g) ΔH=-113.0 kJ·mol–1
请写出NO2与SO2反应生成SO3和NO的热化学方程式____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】16.8 g Fe 跟一定量浓 HNO3 反应,Fe 全部溶解,共收集 NO、NO2 的总体积为 11.2 L(标准状况),所得溶液中 H+的物质的量为 0.02 mol,请回答:
(1)反应中被还原的硝酸为_______________mol。
(2)反应过程中转移电子数为_______________。
(3)生成的 NO 与 NO2 的物质的量之比为__________________。
(4)反应后溶液中 NO3-的物质的量为___________mol。
(5)写出该反应的离子方程式:___________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】写出下列反应的化学反应方程式,并判断其反应类型(加成、取代、氧化)
①甲烷与氯气反应_______________________________,属于________反应
②乙烯通入溴水:_________________________________,属于________反应
③乙醇与金属钠反应:__________________________________,属于________反应
④由苯制取硝基苯:_______________________________,属于________反应;
⑤灼热的铜丝多次反复地插入乙醇中:___________________,属于_______反应;
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列物质在给定条件下的同分异构体数目正确的是( )
A. C4H10属于烷烃的同分异构体有3种
B. 分子组成是C5H10O2属于羧酸的同分异构体有5种
C. 分子组成是C4H8O属于醛的同分异构体有3种
D. 结构简式为![]() 的一溴代物有5种
的一溴代物有5种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮化硅陶瓷能代替金属制造发动机的耐热部件。工业上用化学气相沉积法制备氮化硅,其反应如下:3SiCl4(g)+2N2(g)+6H2(g)![]() Si3N4(s)+12HCl(g) △H<0。若在恒压绝热容器中反应,下列选项表明反应一定已达化学平衡状态的是( )
Si3N4(s)+12HCl(g) △H<0。若在恒压绝热容器中反应,下列选项表明反应一定已达化学平衡状态的是( )
A. 容器的温度保持不变 B. 容器的压强保持不变
C. υ正(N2)=6υ逆(HCl) D. 容器内的气体c(N2)∶c(H2)∶c(HCl)=1∶3∶6
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫代硫酸钠晶体(Na2S2O3·5H2O)又称海波,呈无色透明状,易溶于水,不溶于乙醇,常用作棉织物漂白后的脱氯剂、定量分析中的还原剂。
Ⅰ. Na2S2O3·5H2O的制备
Na2S2O3·5H2O的制备方法有多种,其中亚硫酸钠法是工业和实验室中的主要方法:
Na2SO3+S+5H2O![]() Na2S2O3·5H2O
Na2S2O3·5H2O
制备过程如下:
①称取12.6gNa2SO3于100mL烧杯中,加50mL去离子水搅拌溶解。
②另取4.0g硫粉于200mL烧杯中,加6mL乙醇充分搅拌均匀将其润湿,再加入Na2SO3溶液,隔石棉网小火加热煮沸,不断搅拌至硫粉几乎全部反应。
③停止加热,待溶液稍冷却后加2g活性炭,加热煮沸2分钟(脱色)。
④趁热过滤,得滤液至蒸发皿中,_________________、____________________。
⑤过滤、洗涤,用滤纸吸干后,称重,计算产率。
(1)加入的硫粉用乙醇润湿的目的是____________________________。
(2)步骤④趁热过滤的原因_____________________,空格处应采取的操作是_________________、____________________。
(3)步骤⑤洗涤过程中,为防止有部分产品损失,应选用的试剂为__________________________。
(4)滤液中除Na2S2O3 和未反应完全的Na2SO3外,最可能存在的无机杂质是________________,生成该杂质的原因可能是____________________________。
Ⅱ.产品纯度的测定
准确称取1.00g产品(硫代硫酸钠晶体的摩尔质量为248g/mol),用适量蒸馏水溶解,以淀粉作指示剂,用0.1000mol/LI2的标准溶液滴定,反应的离子方程式为:2S2O32-+I2=S4O62-+2I-,记录数据如下:
滴定次数 | 滴定前读数(mL) | 滴定后读数(mL) |
1 | 0.30 | 21.32 |
2 | 0.36 | 22.56 |
3 | 0.10 | 21.08 |
(5)计算所得产品的纯度为___________(保留三位有效数字),该数据的合理解释可能是__________(不考虑实验操作引起的误差)。
Ⅲ.产品的应用
(6)Na2S2O3 常用于脱氯剂,在溶液中易被Cl2 氧化为SO42-,该反应的离子方程式为 _____________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com