
| A、铁和稀盐酸、铁和稀醋酸 |
| B、FeCl3和NaOH、FeCl3和NH3?H2O |
| C、BaCl2+H2SO4; Ba(OH)2+Na2SO4 |
| D、NaHCO3+NaOH; NaHSO4+NaOH |


科目:高中化学 来源: 题型:
| A、5mol |
| B、3 mol |
| C、5/3 mol |
| D、1 mol |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Fe3+、Mg2+、SO42-、NO3- |
| B、Ag+、Al3+、NO3-、OH- |
| C、Na+、Ba2+,Cl-、ClO- |
| D、K+、Na+、CO32-、NO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、氢氧化钡溶液与盐酸的反应 2OH-+2H+=2H2O |
| B、澄清的石灰水与稀盐酸反应 Ca(OH)2+2H+=Ca2++2H2O |
| C、铜片插入硝酸银溶液中 Cu+Ag+=Cu2++Ag |
| D、碳酸钙溶于稀盐酸中 CaCO3+2H+=Ca2++H2O+CO2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:
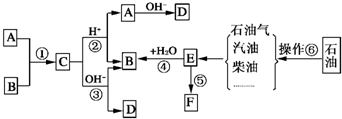 已知:A、B、F是家庭中常见的有机物,F常用于食品包装,E是石油化工发展水平的标志.根据下面转化关系回答问题.
已知:A、B、F是家庭中常见的有机物,F常用于食品包装,E是石油化工发展水平的标志.根据下面转化关系回答问题.查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、强电解质一定是离子化合物,弱电解质一定是共价化合物 |
| B、强电解质一定是易溶于水的化合物,弱电解质一定是难溶于水的化合物 |
| C、CO2的水溶液导电能力很弱,所以CO2是弱电解质 |
| D、属于共价化合物的电解质在熔化状态下一般不导电 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com