
| A. | 浓硫酸和浓盐酸长期暴露在空气中浓度均降低 | |
| B. | SO2能使品红溶液和溴水均褪色 | |
| C. | 氯水和浓硝酸均要盛装在棕色试剂瓶中 | |
| D. | NaCl固体中混有NH4Cl或I2,均可用加热法除去 |
分析 A.浓硫酸具有吸水性、浓盐酸具有挥发性;
B.见光易分解的药品要盛放在棕色试剂瓶中;
C.二氧化硫具有还原性和漂白性;
D.氯化铵受热易分解、碘受热易升华.
解答 解:A.浓硫酸具有吸水性、浓盐酸具有挥发性,浓硫酸和浓盐酸长期暴露在空气中浓度均降低,但原理不同,故A错误;
B.二氧化硫具有还原性和漂白性,二氧化硫能使品红溶液褪色是利用二氧化硫的漂白性,能使溴水褪色是利用二氧化硫的还原性,所以反应原理不同,故B错误;
C.见光易分解的药品要盛放在棕色试剂瓶中,次氯酸和浓硝酸见光都易分解生成其它物质而发生分解反应,反应原理相同,故C正确;
D.氯化铵受热易分解、碘受热易升华,前者是化学变化、后者是物理变化,所以反应原理不同,故D错误;
故选C.
点评 本题考查了元素化合物知识,明确物质的性质是解本题关键,根据物质发生的变化、反应原理来分析解答,题目难度不大.


 学练快车道快乐假期寒假作业系列答案
学练快车道快乐假期寒假作业系列答案 新思维寒假作业系列答案
新思维寒假作业系列答案科目:高中化学 来源: 题型:选择题
| 阳离子 | Na+NH4+Fe3+ |
| 阴离子 | OH- Cl- SO42- |
| A. | 甲中一定含有Na+ | B. | 乙中一定含有NH4+ | ||
| C. | 丙中一定含有 Fe3+ | D. | 丙中一定含有SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
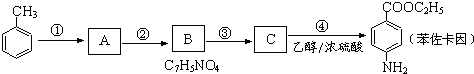
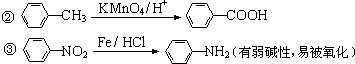
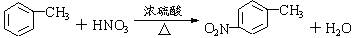 .
.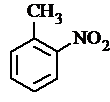 、
、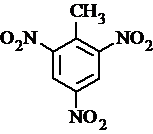 等
等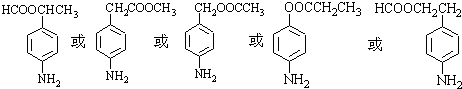 .
.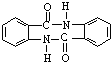 有较好的阻燃性,请写出以甲苯为主要原料制备该阻燃剂的合成路线流程图.提示:①合成过程中无机试剂任选;②合成路线流程图示例如下:
有较好的阻燃性,请写出以甲苯为主要原料制备该阻燃剂的合成路线流程图.提示:①合成过程中无机试剂任选;②合成路线流程图示例如下: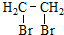
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①② | B. | ①②④ | C. | ①③④ | D. | ①②③④ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 ;
;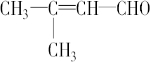 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| T/℃ | 165 | 175 | 185 | 195 |
| K | 111.9 | 74.1 | 50.6 | 34.8 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com