
【题目】下列各组元素中,在生物体内含量极少,但对维持生物体正常活动必不可少的一组是( )
A. Fe、Mn、Zn、Mg B. Zn、Cu、Mg、Ca
C. Zn、Cu、B、Mn D. S、Mn、Cu、Mo
科目:高中化学 来源: 题型:
【题目】下列关于电解质电离的叙述中正确的是( )
A.CaCO3在水中溶解度很小,其导电能力很弱,所以CaCO3是弱电解质
B.CaCO3在水中溶解度很小,但溶解的CaCO3全部电离,所以CaCO3是强电解质
C.氯气和氨气的水溶液导电性都很好,所以它们是强电解质
D.水难电离,纯水几乎不导电,水是非电解质
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某实验小组用 0.50 mol/L NaOH 溶液和 0.50 mol/L H2SO4 溶液进行中和热的测定。
Ⅰ.配制 0.50 mol/L NaOH 溶液
(1)实验中大约要使用 245 mL NaOH 溶液,则至少需要称量 NaOH 固体 g。
(2)从表中选择称量 NaOH 固体所需要的仪器 (填序号)。

Ⅱ.测定中和热的实验装置如图所示。

(3)写出稀硫酸和稀 NaOH 溶液反应表示中和热的热化学方程式 (中和热为 57.3 kJ/mol)。

①温度差的平均值为__________。
②使硫酸与 NaOH 溶液混合均匀的正确操作是 (填字母)。
A.用温度计小心搅拌 B.揭开硬纸片用玻璃棒搅拌
C.轻轻地振荡烧杯 D.用套在温度计上的环形玻璃搅拌棒轻轻地搅动
③近似认为 0.50 mol/L NaOH 溶液和 0.50 mol/L 硫酸的密度都是 1g/cm3,中和后生成溶液的比热容 c = 4.18 J/(g·℃),则中和热 Δ H= ________(结果保留小数点后一位)。
④上述实验结果与 57.3 kJ/mol 有偏差,产生偏差的原因可能是__________(填字母)。
A.实验装置保温、隔热效果差
B.量取 NaOH 溶液的体积时仰视读数
C.分多次把 NaOH 溶液倒入盛有硫酸的小烧杯中
D.用温度计测定 NaOH 溶液起始温度后直接测量 H2SO4 溶液的温度
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某溶液中含有较大量的Cl-、CO![]() 、OH-3种阴离子,如果只取一次该溶液就能够分别将3种阴离子依次沉淀出来,下列实验操作顺序正确的是( )
、OH-3种阴离子,如果只取一次该溶液就能够分别将3种阴离子依次沉淀出来,下列实验操作顺序正确的是( )
①滴加Mg(NO3)2溶液 ②过滤 ③滴加AgNO3溶液 ④滴加Ba(NO3)2溶液
A.①②④②③ B.④②①②③
C.①②③②④ D.④②③②①
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在不同浓度(c)、温度(T)条件下,蔗糖发生水解反应(已知水解反应为吸热反应)的瞬时速率(v)如下表。下列判断不正确的是( )
| 0.600 | 0.500 | 0.400 | 0.300 |
318.2 | 3.60 | 3.00 | 2.40 | 1.80 |
328.2 | 9.00 | 7.50 | a | 4.50 |
b | 2.16 | 1.80 | 1.44 | 1.08 |
A.a=6.00 B.不同温度时,蔗糖浓度减少一半所需的时间相同
C.b<318.2 D.同时改变反应温度和蔗糖的浓度,v可能不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】研究大气中含硫化合物(主要是SO2和H2S)的转化具有重要意义。
(1)高湿条件下,写出大气中SO2转化为HSO3-的方程式: 。
(2)土壤中的微生物可将大气中H2S经两步反应氧化成SO42-,两步反应的能量变化示意图如下:
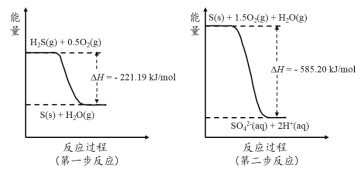
1mol H2S(g)全部氧化成SO42-(aq)的热化学方程式为 。
(3)二氧化硫—空气质子交换膜燃料电池可以利用大气所含SO2快速启动,其装置示意图如下:
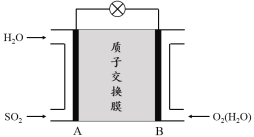
① 质子的流动方向为 (“从A到B”或“从B到A”)。
② 负极的电极反应式为 。
(4)燃煤烟气的脱硫减排是减少大气中含硫化合物污染的关键。SO2烟气脱除的一种工业流程如下:
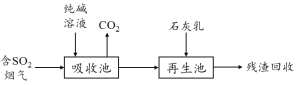
用纯碱溶液吸收SO2将其转化为HSO3-,反应的离子方程式是 。
若石灰乳过量,将其产物再排回吸收池,其中可用于吸收SO2的物质的化学式是 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A、同温同压下,H2(g)+Cl2(g)=2HCl(g)在光照和点燃条件下的ΔH相同
B、已知甲烷的标准燃烧热为ΔH=-890.3 kJ/mol 则甲烷燃烧热的热化学方程式为:CH4 (g) + 2O2 (g) = CO2(g) + 2H2O(g) ΔH=-890.3 kJ/mol
C、一定条件下,0.5 mol N2 和1.5 mol H2在密闭容器中充分反应生成NH3,放热19.3 kJ,其热化学方程式为:N2 (g)+ H2 (g)![]() 2NH3(g) ΔH =-38.6 kJ/mol
2NH3(g) ΔH =-38.6 kJ/mol
D、2H+(aq)+SO42-(aq)+Ba2+(aq)+2OH-(aq)=BaSO4(s)+2H2O(l)ΔH=-57.3kJ/mol
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com