
 第二周期中碳、氮、氧是构成生命物质的三种主要元素,在生产生活中也有着重要的应用.
第二周期中碳、氮、氧是构成生命物质的三种主要元素,在生产生活中也有着重要的应用.| 4+2 |
| 2 |
| 4+0 |
| 2 |


科目:高中化学 来源: 题型:
| A、氢氧化铁胶体中滴加盐酸 |
| B、偏铝酸钠溶液中加盐酸 |
| C、氯化铝溶液中滴加氢氧化钠溶液 |
| D、氯化铝溶液中滴加氨水 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、1项 | B、2项 | C、3项 | D、4项 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、2.3gNa与一定量氧气发生反应,钠无剩余,则转移电子数一定为0.1NA |
| B、常温常压下,100g17%H2O2水溶液中含氧原子总数为NA |
| C、常温常压下,2.24LN2气体分子中所含的共用电子对数目为0.3NA |
| D、5.6Fe分别足量氯气、盐酸反应,转移电子数都是0.2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
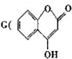 是一种合成多环化台物的中间体,可由下列路线合成(部分反应条件略去):
是一种合成多环化台物的中间体,可由下列路线合成(部分反应条件略去):

查看答案和解析>>
科目:高中化学 来源: 题型:
| A、化学反应能够制造新物质,同时也能制造出新的元素 |
| B、煤在空气中强热得到焦炭、煤焦油、焦炉气、粗氨水等产物的过程叫煤的干馏 |
| C、在酿酒的过程中,葡萄糖可通过水解反应生成酒精 |
| D、工业生产玻璃、水泥、冶炼铁均需要用到石灰石为原料 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Y、Z、W分别与X组成的化合物稳定性依次减弱 |
| B、W和Y形成的化合物可能与X与Z形成的化合物反应 |
| C、X与Y形成的化合物的水溶液一定呈碱性 |
| D、上述四种元素原子半径大小为X<Y<Z<W |
查看答案和解析>>
科目:高中化学 来源: 题型:

 )
)查看答案和解析>>
科目:高中化学 来源: 题型:
| A、常温常压下,104 g苯乙烯中含有的碳碳双键数为NA |
| B、5.6克铁与足量盐酸反应,转移0.3NA个电子 |
| C、2mol的甲基(-CH3)所含电子数为14NA |
| D、标准状况下,22.4L辛烷完全燃烧生成二氧化碳分子数为8NA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com