
接触法制硫酸工艺中,其主反应在450℃并有催化剂存在下进行:2SO2(g) + O2(g) 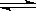 2SO3(g)
2SO3(g)  H=-197 kJ/mol。下列说法正确的是
H=-197 kJ/mol。下列说法正确的是
A.使用催化剂可以提高该反应的焓变
B.增大O2的浓度可以提高反应速率和SO2的转化率
C.反应450℃时的平衡常数小于500℃时的平衡常数
D.2 mol SO2(g) 和1 mol O2(g)所含的总能量小于2 mol SO3(g) 所含的总能量
科目:高中化学 来源:2017届河北省高三上10.6周测化学试卷(解析版) 题型:选择题
H2S水溶液中存在电离平衡H2S H++HS-和HS-
H++HS-和HS- H++S2-,若向H2S溶液中
H++S2-,若向H2S溶液中
A.加水,平衡向右移动,溶液中氢离子浓度增大
B.通入过量SO2气体,平衡向左移动,溶液pH值增大
C.滴加新制氯水,平衡向左移动,溶液pH值减小
D.加入少量硫酸铜固体(忽略体积变化),溶液中所有离子浓度都减小
查看答案和解析>>
科目:高中化学 来源:2017届甘肃省高三上学期第一次月考化学卷(解析版) 题型:选择题
以下各组离子因发生氧化还原反应而不能大量共存的是( )
A.H+、Fe2+、Cr2O 、SO
、SO B.Ca2+、H+、SO
B.Ca2+、H+、SO 、HCO
、HCO

C.Na+、Cu2+、Cl-、S2- D.Fe3+、K+、SCN-、Cl-
查看答案和解析>>
科目:高中化学 来源:2016-2017学年河北省高二上10月月考化学卷(解析版) 题型:选择题
用图M1—2所示装置制取纯净的Fe(OH)2,下列说法不正确的是

A.a电极一定是铁,电解液c可以是CuCl2溶液
B.电解一段时间,b电极附近pH升高
C.溶液中的阴离子向a电极移动
D.在加入苯之前应将电解液c加热煮沸
查看答案和解析>>
科目:高中化学 来源:2016-2017学年河北省高二上10月月考化学卷(解析版) 题型:选择题
某模拟“人工树叶”电化学实验装置如下图所示,该装置能将H2O和CO2转化为O2和燃料(C3H8O)。下列说法正确的是
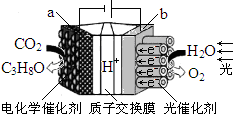
A.该装置将化学能转化为光能和电能
B.该装置工作时,H+从b极区向a极区迁移
C.每生成1mol O2,有44gCO2被还原
D.a电极的反应为:3CO2+18H+-18e-=C3H8O+5H2O
查看答案和解析>>
科目:高中化学 来源:2016-2017学年广西省高二上9月月考化学卷(解析版) 题型:填空题
t℃时,将3molA和lmolB气体通入体积为2L的密闭容器中(保持容积不变),发生如下反应:3 A(g)+B(g)  xC(g) △H<0;在2min时达到平衡状态(温度不变)剩余了0.8molB,并测得C的浓度为0.4mol/L。请填写列空白:
xC(g) △H<0;在2min时达到平衡状态(温度不变)剩余了0.8molB,并测得C的浓度为0.4mol/L。请填写列空白:
(1)从开始反应至达到平衡状态,生成B的平均反应速率为__________。
(2)x=___________,平街常数K=___________。
(3)若继续向原平衡混合物的容器中通入少量氯气 (假设氮气和A、B、C都不反应)后,化学平衡(填字母)____ ________。若通入气体A后,化学平衡将___________。
A.向正反应方向移动 B.向逆反应方向移动 C.不移动
(4)若向原平衡混合物的作器中再充入amolC,在t℃时达到新的平衡,此时B的物质的量为n(B)=__________mol。
(5)如果上述反应在相同温度和容器中进行,欲使反应达到平衡时C的物质的量分数与原平衡相等,起始加入的下种物质的物质的分n (A)、n(B)、n(C)之间应该满足的关系式为___________。
查看答案和解析>>
科目:高中化学 来源:2016-2017学年广西省高二上9月月考化学卷(解析版) 题型:选择题
下列叙述正确的是( )
A.在醋酸溶液的pH, 将此溶液稀释l倍后,溶液的pH =b , 则a>b
B.在滴有酚酞溶液的氮水里,加入NH4Cl至溶液恰好无色,刻此时溶液的pH <7
C.l.0×10-3mol/L盐酸的pH=3.0,l.0×10-8mol/L盐酸的pH=8.0
D.若1mLpH=1的盐酸与100mLNaOH溶液混合后,溶液的pH=7,则NaoH溶液的pH=11
查看答案和解析>>
科目:高中化学 来源:2016-2017学年甘肃省高二上第一次月考化学卷(解析版) 题型:选择题
下列关于糖类、蛋白质、油脂和维生素的说法中,正确的是( )
A.它们的组成都含有C、H、O、N等元素
B.在一定条件下,它们都能发生水解反应
C.人体需要的二十多种氨基酸,都可以通过人体自身合成
D.油脂都是高级脂肪酸的甘油酯,是一种高热量营养物质
查看答案和解析>>
科目:高中化学 来源:2017届山西省高三上学期10月月考化学试卷(解析版) 题型:填空题
“神十搭载的长征F改进型火箭推进剂之一为无色气体N2O4.N2O4与NO2转换的热化学方程式为:N2O4(g)  2NO2(g) △H=+24.4KJ/mol
2NO2(g) △H=+24.4KJ/mol
(1)将一定量N2O4投入固定容积的真空容器中,下述现象能说明反应达到平衡的是 。
a.v正(N2O4)=2v逆(NO2) b.体系颜色不变
c.气体平均相对分子质量不变 d.气体密度不变
达到平衡后,保持体积不变升高温度,再次到达平衡时,则混合气体颜色 (填“变深”、“变浅”或“不变”),判断理由____________________。
(2)平衡常数K可用反应体系中气体物质分压表示,即K表达式中用平衡分压代替平衡浓度,分压=总压×物质的量分数(例如:p(NO2)=p总×x(NO2)。写出上述反应平衡常数Kp表达式 (用p总、各气体物质的量分数x表示)。影响Kp的因素为___________;
(3)上述反应中,正反应速率v正=k正·p(N2O4),逆反应速率v逆=k逆·P2(NO2),其中k正、k逆为速率常数,则Kp为________(以k正、k逆表示)。若将一定量N2O4投入真空容器中恒温恒压分解(温度298K、压强100kPa),已知该条件下k正=4.8×l04s-1,当N2O4分解10%时,v正=__________kPa·s-1;
(4)真空密闭容器中放入一定量N2O4,维持总压强p0恒定,在温度为T时,平衡时N2O4分解百分率为a。保持温度不变,向密闭容器中充人等量N2O4,维持总压强在2p0条件下分解,则N2O4的平衡分解率的表达式为 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com