
【题目】砷化镓(GaAs)是优良的半导体材料,可用于制作微型激光器或太阳能电池的材料等。回答下列问题:
(1)基态Ga原子的核外电子排布式为[Ar]____。
(2)根据元素周期律,元素的电负性Ga____(填“大于”或“小于”,下同)As,第一电离能B____Ga;BF3和NH3的分子能够通过配位键相结合的原因是____。
(3)杀虫剂Na3AsO4中阴离子的空间构型为____,As原子采取____杂化。
(4)GaF3的熔点高于1000℃,GaCl3的熔点为77.9℃,其原因是____。
(5)原子晶体GaAs的晶胞参数a=x pm,它的晶胞结构如下图所示。该晶胞内部存在的共价键数为____;该晶体的密度为______g/cm3(阿伏加德罗常数的值用NA表示)。
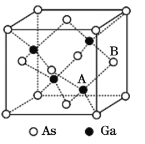
【答案】3d104s24p1 小于 大于 NH3中的N具有孤对电子,BF3中的B核外具有空轨道 正四面体 sp3 GaF3是离子晶体,GaCl3是分子晶体,离子晶体GaF3的熔沸点高 16 ![]()
【解析】
(1)Ga是31号元素,位于元素周期表第四周期第ⅢA,则基态Ga原子的核外电子排布式是[Ar]3d104s24p1;
(2)同一周期的元素,原子序数越大,元素的非金属性越强。元素的非金属性Ga<As,所以元素的电负性Ga<As;同一主族的元素,原子序数越大,元素的原子半径越大,原子失去电子就越容易,其第一电离能就越小,由于元素的非金属性B>Ga,所以第一电离能B>Ga;BF3和NH3的分子能够通过配位键相结合,是由于NH3中N提供孤电子对,BF3中B提供空轨道;
(3)杀虫剂Na3AsO4中阴离子为AsO43-,根据VSEPR理论,价电子对数VP=4+![]() =4,则其空间构型为正四面体;根据杂化轨道理论,中心As的杂化方式为sp3杂化;
=4,则其空间构型为正四面体;根据杂化轨道理论,中心As的杂化方式为sp3杂化;
(4)组成相似的GaF3和GaCl3晶体,前者属于离子晶体,后者属于分子晶体,离子键比分子间作用力大得多,所以前者的熔沸点比后者高;
(5)一个Ga与周围4个As形成共价键,所以晶胞内存在共价健数为4×4=16;在一个晶胞中含有的As原子个数为8×![]() +6×
+6×![]() =4,含有的Ga原子个数为4个,则1mol晶胞的质量m=4×145g=580g,1个晶胞的体积为V=a3pm3=(x×10-10)3cm3,所以晶体密度为ρ=
=4,含有的Ga原子个数为4个,则1mol晶胞的质量m=4×145g=580g,1个晶胞的体积为V=a3pm3=(x×10-10)3cm3,所以晶体密度为ρ=![]() g/cm3=
g/cm3=![]() g/cm3。
g/cm3。


 世纪百通主体课堂小学课时同步达标系列答案
世纪百通主体课堂小学课时同步达标系列答案 世纪百通优练测系列答案
世纪百通优练测系列答案 百分学生作业本题练王系列答案
百分学生作业本题练王系列答案科目:高中化学 来源: 题型:
【题目】能源危机是当前全球性的问题,“开源节流”是应对能源危机的重要举措。
(1)下列做法有助于能源“开源节流”的是________(填序号)。
A.大力发展农村沼气,将废弃的秸秆转化为清洁高效的能源
B.大力开采煤、石油和天然气以满足人们日益增长的能源需求
C.开发太阳能、水能、风能、地热能等新能源,减少使用煤、石油等化石燃料
D.减少资源消耗,增加资源的重复使用、资源的循环再生
(2)金刚石和石墨均为碳的同素异形体,它们在氧气不足时燃烧生成一氧化碳,氧气充足时燃烧生成二氧化碳,反应中放出的热量如图所示。
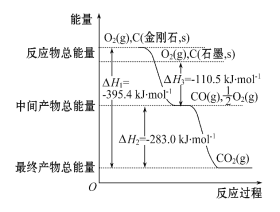
①在通常状况下,________(填“金刚石”或“石墨”)更稳定,石墨的燃烧热为ΔH= ____________。
②12 g石墨在24 g氧气中燃烧,生成气体36 g,该过程放出的热量为________。
(3)已知:N2、O2分子中化学键的键能分别是946 kJ·mol-1、497 kJ·mol-1。
N2(g)+O2(g)=2NO(g) ΔH=+180.0 kJ·mol-1。
NO分子中化学键的键能为________kJ·mol-1。
(4)综合上述有关信息,请写出CO和NO反应的热化学方程式:_________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关说法正确的是( )
①室温下,向AgCl浊液中加入少量NaCl饱和溶液,则c(Ag+)、Ksp(AgCl)均减小
②在![]() =1012溶液中 Na+、I-、NO3-、SO42-不能大量共存
=1012溶液中 Na+、I-、NO3-、SO42-不能大量共存
③在原电池装置中,电子从负极流出,沿导线流入正极,经溶液或盐桥回到负极
④锅炉水垢中含有的CaSO4,可先用Na2CO3溶液处理,后用酸除去
⑤高纯度的硅单质广泛用于制作光导纤维,光导纤维遇强碱会“断路”
⑥用0.1 mol/LCH3COOH溶液滴定0.1 mol/LNaOH溶液至中性时:c(CH3COO-)+c(CH3COOH)>c(Na+)
⑦100℃时,将pH=2的盐酸与pH=12的NaOH溶液等体积混合,溶液显中性
⑧向饱和NaC1溶液中先通入足量CO2,再通入足量NH3,可析出NaHCO3晶体
A.②④⑥B.①②⑦C.①④⑤D.③⑤⑧
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】金属镍在工业上应用广泛,请回答下列问题。
(1) Ni是元素周期表中第28号元素,第二周期基态原子未成对电子数与Ni相同且电负性最小的元素是____(用元素符号表示)。
(2) 过渡金属配合物Ni(CO)n的中心原子价电子数与配体提供电子总数之和为18,则n=____。与CO互为等电子体的阴离子是____(只写一种),CO分子内σ键与π键个数之比为____。1mol Ni(CO)n中含σ键为____ mol。
(3) 甲醛(H2C=O)在Ni催化作用下加氢可得甲醇(CH3OH)。甲醛分子内C原子的杂化方式为____,甲醇分子内的O—C—H键角____(填“大于”“等于”或“小于”)甲醛分子内的O—C—H键角。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A.钢铁浸泡于食盐水中发生电化学腐蚀时的正极反应为:2H2O+2e-=H2↑+2OH-
B.增大气体压强或使用催化剂能能提高活化分子的百分数,从而加快反应速率
C.反应2CO(g)=2C(s)+O2(g) ΔS<0在任何条件下都不能自发进行
D.工业上合成氨反应N2(g)+3H2(g) ![]() 2NH3(g) ΔH<0采用高温是为了提高N2的平衡转化率
2NH3(g) ΔH<0采用高温是为了提高N2的平衡转化率
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法中正确的是![]()
A.动物体内葡萄糖被氧化成![]() 是热能转变成化学能的过程
是热能转变成化学能的过程
B.![]() 与
与![]() 反应生成
反应生成![]() 沉淀时放出的热叫做中和热
沉淀时放出的热叫做中和热
C.热化学方程式中的化学计量数只表示物质的量,可以是分数
D.![]() 与
与![]() 反应放出的热就是
反应放出的热就是![]() 的燃烧热
的燃烧热
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】绿矾是含有一定量结晶水的硫酸亚铁,在工农业生产中具有重要的用途。某化学兴趣小组对绿矾的一些性质进行探究。回答下列问题:
(1)在试管中加入少量绿矾样品,加水溶解,滴加KSCN溶液,溶液颜色无明显变化。再向试管中通入空气,溶液逐渐变红。由此可知:______、______。
(2)为测定绿矾中结晶水含量,将石英玻璃管(带两端开关K1和K2)(设为装置A)称重,记为m1 g,将样品装入石英玻璃管中,再次将装置A称重,记为m2g,按如图连接好装置进行实验。
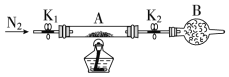
①仪器B的名称是______。
②将下列实验操作步骤正确排序______(填标号);重复上述操作步骤,直至A恒重,记为m3 g。
a.点燃酒精灯,加热 b.熄灭酒精灯 c.关闭K1和K2
d.打开K1和K2,缓缓通入N2 e.称量A f.冷却到室温
(3)为探究硫酸亚铁的分解产物,将(2)中已恒重的装置A接入下图所示的装置中,打开K1和K2,缓缓通入N2,加热。实验后反应管中残留固体为红色粉末。
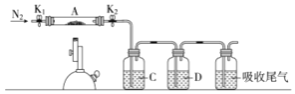
①C、D中的溶液依次为______(填标号)。C、D中有气泡冒出。
A.NaOH B.品红 C.浓H2SO4 D.Ba(NO3)2 E.BaCl2
②写出硫酸亚铁高温分解反应的化学方程式__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据下列各图曲线表征的信息,得出的结论不正确的是


A. 图1表示常温下向体积为10 mL 0.1 mol·L-1NaOH溶液中逐滴加入0.1 mol·L-1CH3COOH溶液后溶液的pH变化曲线,则b点处有:c(CH3COOH)+c(H+)=c(OH-)
B. 图2表示用水稀释pH相同的盐酸和醋酸时溶液的pH变化曲线,其中Ⅰ表示醋酸,Ⅱ表示盐酸,且溶液导电性:c>b>a
C. 图3表示H2与O2发生反应过程中的能量变化,H2的燃烧热为285.8 kJ·mol-1
D. 由图4得出若除去CuSO4溶液中的Fe3+,可采用向溶液中加入适量CuO,调节溶液的pH至4左右
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】计算机芯片是一种用硅材料制成的薄片,其大小仅有手指甲的一半。一个芯片是由几百个微电路连接在一起的,体积很小,在芯片上布满了产生脉冲电流的微电路。计算机芯片利用这些微电流,就能够完成控制计算机、计算机自动化装置和其它各种设备所需要的操作。高纯硅是制备半导体材料的重要物质,工业上制备纯硅的方程式为:①![]() ②
②![]() ③
③![]() ;
;
![]() 的反应属于( )
的反应属于( )
A.置换反应B.化合反应C.分解反应D.复分解反应
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com