
| A. | “两水”都能与FeCl2溶液反应 | |
| B. | “两水”中都存在可逆反应 | |
| C. | “两水”都有刺激性气味 | |
| D. | “两水”都是混合物,溶液中含有的粒子种类数相同 |
分析 新制的氨水中含氨气、水、一水合氨、H+、OH-、NH4+,氯水中含氯气、水、HClO、Cl-、ClO-、H+、OH-,结合溶液中存在的微粒及性质来解答.
解答 解:A.氨水中含有氢氧根离子能够与二价铁离子反应生成氢氧化亚铁,氯水中含有氯气能够氧化二价铁离子生成三价铁离子,所以“两水”都能与FeCl2溶液反应,故A正确;
B.一水合氨、次氯酸都是弱电解质,都是部分电离,存在电离平衡,故B正确;
C.氨水中含有氨气、氯水中含有氯气,氨气和氯气都具有刺激性气味,故C正确;
D.均为混合物,但氨水中含6种微粒,氯水中含7种微粒,故D错误;
故选:D.
点评 本题考查氯水和氨水的组成和性质,为高频考点,侧重于学生的分析能力和基础知识的综合考查,明确氯水、氨水成分是解题关键.


科目:高中化学 来源: 题型:选择题
| A. | 煤中存在苯、二甲苯,工业上可由煤蒸馏获得 | |
| B. | 直馏汽油和裂化汽油中分别加入溴的四氯化碳溶液均能发生化学反应 | |
| C. | 石油的裂化、裂解和煤的干馏、气化都属于化学变化 | |
| D. | 石油裂解是生产乙烯的主要方法,乙烯和聚乙烯均能使溴水发生反应而褪色 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 混合气体的密度不再发生变化 | |
| B. | 反应速率之比υ(N2):υ(H2):υ(NH3)=1:3:2 | |
| C. | 每生成3molH2的同时消耗2molNH3 | |
| D. | 每断裂1molN≡N键的同时断裂6molN-H键 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
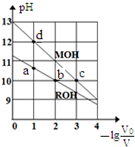 常温下,向体积均为V0、浓度均为c mol•L-1的MOH和ROH溶液中分别加水稀释至体积为V,溶液pH随-1g$\frac{{V}_{0}}{V}$的变化如图所示.下列叙述正确的是( )
常温下,向体积均为V0、浓度均为c mol•L-1的MOH和ROH溶液中分别加水稀释至体积为V,溶液pH随-1g$\frac{{V}_{0}}{V}$的变化如图所示.下列叙述正确的是( )| A. | 碱性:MOH>ROH | |
| B. | b、c两点的溶液中:c(R+)>c(M+) | |
| C. | 溶液中水的电离程度α:αc>αb>αa>αd | |
| D. | c>0.1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
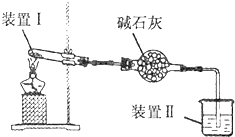 按如图所示装置进行实验,装置中现象II不正确的是( )
按如图所示装置进行实验,装置中现象II不正确的是( )| 选项 | 装置I中试剂 | 装置Ⅱ中试剂 | 装置Ⅱ中现象 |
| A | 浸透了石蜡油的石棉和碎瓷片 | 酸性高锰酸钾溶液 | 紫色溶液褪色 |
| B | 铁粉和用水浸泡的棉团 | 肥皂水 | 肥皂水冒泡 |
| C | 碳酸氢钠 | 澄清石灰水 | 有沉淀生成 |
| D | 硫酸铵 | 酚酞溶液 | 溶液变红 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 食盐水、稀豆浆、蔗糖水都能产生丁达尔效应 | |
| B. | 14C可用于文物的鉴定,14C与12C互为同素异形体 | |
| C. | 新能源汽车的推广与使用有助于减少光化学烟雾的产生 | |
| D. | 黑火药含有硫磺、硝酸钾和木炭,其中硝酸钾是电解质,硫磺和木炭是非电解质 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原子半径:X<Y<W<Z | |
| B. | 由 W与Y组成的分子都是非极性分子 | |
| C. | 由 Z与Y组成的化合物都能与水反应 | |
| D. | X与氢元素组成的化合物的沸点都低于Y与氢元素组成的化合物 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com