
【题目】下列各组物质既不属于同系物,也不属于同分异构体的是( )
A.CH3-CH2-CH3和CH3-CH2-CH2-CH3
B.CH3CH2CH=CH2和![]()
C.![]() 和
和![]()
D.乙酸和甲酸甲酯
科目:高中化学 来源: 题型:
【题目】电解硫酸钠溶液联合生产硫酸和烧碱溶液的装置如图所示,其中阴极和阳极均为惰性电极。测得同温同压下,气体甲与气体乙的体积比约为1∶2,以下说法正确的是( )
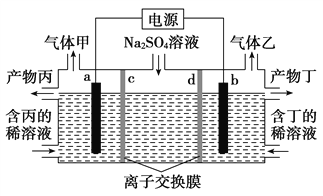
A. a极与电源的负极相连
B. 产物丙为硫酸
C. 离子交换膜d为阴离子交换膜
D. a电极反应式:2H2O+2e-===H2↑+2OH-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】反应2HClO+Mg=Mg(ClO)2++H2↑。下列表示反应中相关微粒的化学用语正确的是
A.中子数为20的氯原子:![]() ClB.次氯酸的电离方程式:HClO=H++ClO-
ClB.次氯酸的电离方程式:HClO=H++ClO-
C.次氯酸的电子式:![]() D.镁离子的结构示意图:
D.镁离子的结构示意图:![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A.铅蓄电池放电时,正极每增加96g,转移电子数目为2×6.02×1023
B.反应2Cu+CO2+O2+H2O =Cu2(OH)2CO3在常温下可自发,则该反应ΔH<0
C.常温下,将稀CH3COONa溶液加水稀释后n(H+)·n(OH-)不变
D.保持温度不变,向稀氨水中缓慢通入CO2,溶液中![]() 的值减小
的值减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,在三个体积均为2.0 L的恒容密闭容器中发生如下反应:PCl5(g)PCl3(g)+Cl2(g)
编号 | 温度(℃) | 起始物质的量 (mol) | 平衡物质的量 (mol) | 达到平衡所需时间 (s) | |
PCl5(g) | PCl3(g) | Cl2(g) | |||
Ⅰ | 320 | 0.40 | 0.10 | 0.10 | t1 |
Ⅱ | 320 | 0.80 | t2 | ||
Ⅲ | 410 | 0.40 | 0.15 | 0.15 | t3 |
下列说法正确的是
A.平衡常数K:容器Ⅱ>容器Ⅲ
B.反应到达平衡时,PCl5的转化率:容器Ⅱ<容器Ⅰ
C.反应到达平衡时,容器Ⅰ中的平均速率为v(PCl5)=![]() mol/(L·s)
mol/(L·s)
D.起始时向容器Ⅲ中充入PCl5 0.30mol、PCl3 0.45 mol和Cl2 0.15 mol,则反应将向逆反应方向进行
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】分枝酸可用于生化研究。其结构简式如图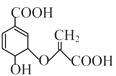 。下列关于分枝酸的叙述正确的是( )
。下列关于分枝酸的叙述正确的是( )
A.分子中含有3种官能团
B.可与乙醇、乙酸反应,且反应类型相同
C.1mol分枝酸最多可与3molNaOH发生中和反应
D.可使溴的四氯化碳溶液、酸性高锰酸钾溶液褪色,且原理相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】把质量为mg的铜丝灼烧变黑,立即放入下列物质中,能使铜丝变红而且质量仍为mg的是
A.NaOH溶液B.CH3COOHC.稀HNO3D.CH3CH2OH
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机物甲的结构简式为![]() ,它可以通过下列路线合成(分离方法和其他产物 已经略去)。下列说法不正确的是( )
,它可以通过下列路线合成(分离方法和其他产物 已经略去)。下列说法不正确的是( )
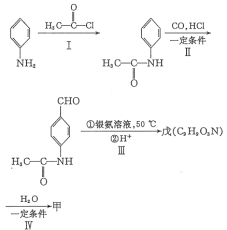
A.甲可以发生取代反应、加成反应
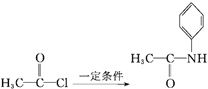
B.步骤Ⅰ的反应方程式是![]() +
+ 
C.步骤Ⅳ的反应类型是取代反应
D.步骤Ⅰ和Ⅳ在合成甲过程中的目的是保护氨基不被氧化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】天然气水蒸汽重整法是工业上生产氢气的重要方法,反应在 400℃以上进行。l 00kPa 时,在反应容器中通入甲烷与为水蒸汽体积比为1 : 5的混合气体,发生下表反应。
反应方程式 | 焓变△H(kJ/mol) | 600℃时的平衡常数 |
①CH4(g)+ H2O(g) | a | 0.6 |
②CH4(g)+ 2H2O(g) | +165.0 | b |
③CO(g)+ H2O(g) | -41.2 | 2.2 |
请回答下列下列问题:
(1)上表中数据 a=__________; b= ___________ 。
(2)对于反应②,既能加快反应又能提高CH4转化率的措施是_____________。
A.升温 B.加催化剂 C.加压 D.吸收CO2
(3)下列情况能说明容器中各反应均达到平衡的是___________。
A.体系中H2O与CH4物质的量之比不再变化
B.体系中H2的体积分数保持不变
C.生成n 个CO2的同时消耗2n个H2O
D. v正(CO)= v逆(H2)
(4)工业重整制氢中,因副反应产生碳会影响催化效率,需要避免温度过高以减少积碳。该体系中产生碳的反应方程式为 _______________。
(5)平衡时升温,CO含量将_________(选填“增大”或“减小”)。
(6)一定温度下 ,平衡时测得体系中 CO2和H2的物质的量浓度分别是0.75mo l/L、4.80mol/L , 则此时体系中CO 物质的量浓度是_______ mol/L。
(7)改变上述平衡体系的温度,平衡时H2O与CH4物质的量之比[![]() ]值也会随着改变,在图中画出其变化趋势。________________
]值也会随着改变,在图中画出其变化趋势。________________
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com