
下列关于电解精炼铜的叙述中不正确的是()
A. 粗铜板:阳极
B. 电解时,阳极发生氧化反应,而阴极发生的反应为Cu2++2e﹣═Cu
C. 粗铜中所含Na、Fe、Zn等杂质,电解后以单质形式沉积槽底,形成阳极泥
D. 电解铜的纯度可达99.95%﹣99.98%
考点: 电解原理.
专题: 电化学专题.
分析: 电镀法精炼铜时,粗铜为阳极,精铜为阴极,阳极材料是粗铜,阳极上金属失电子变成离子进入溶液,Cu﹣2e﹣=Cu2+,比金属铜活泼的金属锌、铁、镍会先于金属铜失电子,比金属铜活泼性差的Pt、Ag等固体会沉积下来形成阳极泥,这样最终电解铜的纯度可达99.95%~99.98%,根据电解原理来回答.
解答: 解:A、电镀法精炼铜时,粗铜为阳极,精铜为阴极,故A正确;
B、电解时,阳极上只要是金属Cu失电子变成离子进入溶液,Cu﹣2e﹣=Cu2+,阳极发生氧化反应,而阴极发生的反应为:Cu2++2e﹣=Cu,故B正确;
C、粗铜中所含Pt、Au、Ag等金属杂质,电解后以单质形式沉积槽底,形成阳极泥,而金属镍、铁、锌都比铜活泼,先于金属铜失电子,故C错误;
D、根据电解精炼铜的工作原理,这样最终电解铜的纯度可达99.95%~99.98%,故D正确.
故选C.
点评: 本题考查学生电解精炼铜的工作原理,可以根据教材知识来回答,注意教材知识的梳理和记忆,难度不大.


科目:高中化学 来源: 题型:
实脸室采用MgCl2、AlCl3的混合溶液与过量氨水反应制备MgAl2O4二主要流程如下:


(1)为使Mg2+、Al3+同时生成沉淀,应先向沉淀反应器中加入 (填“A”或“B"),再滴加另一反应物。
(2)如右图所示,过滤操作中的一处错误是 。
(3)判断流程中沉淀是否洗净所用的试剂是 。高温焙烧时,用于盛放固体的仪器名称是 。
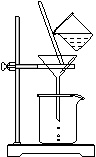

(4)无水AlCl3(183℃升华)遇潮湿空气即产生大量白雾,实验室可用下列装置制备。


装置B中盛放饱和NaCl溶液,该装置的主要作用是 。F中试剂的作用是 。用一件仪器装填适当试剂后也可起到F和G的作用,所装填的试剂为 _。
查看答案和解析>>
科目:高中化学 来源: 题型:
Na2S2O3是重要的化工原料,易溶于水,在中性或碱性环境中稳定。

Ⅰ.制备Na2S2O3·5H2O
反应原理:Na2SO3(aq)+S(s)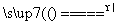 Na2S2O3(aq)
Na2S2O3(aq)
实验步骤:
①称取15 g Na2SO3加入圆底烧瓶中,再加入80 mL蒸馏水。另取5 g研细的硫粉,用3 mL乙醇润湿,加入上述溶液中。
②安装实验装置(如图所示,部分夹持装置略去),水浴加热,微沸60 min。
③趁热过滤,将滤液水浴加热浓缩,冷却析出Na2S2O3·5H2O,经过滤、洗涤、干燥,得到产品。
回答问题:
(1)硫粉在反应前用乙醇润湿的目的是__________________________。
(2)仪器a的名称是________,其作用是____________________。
(3)产品中除了有未反应的Na2SO3外,最可能存在的无机杂质是______________。检验是否存在该杂质的方法是____________________________。
(4)该实验一般控制在碱性环境下进行,否则产品发黄,用离子反应方程式表示其原因:________________________________________________________________________
________________________________________________________________________。
Ⅱ.测定产品纯度
准确称取W g产品,用适量蒸馏水溶解,以淀粉作指示剂,用0.100 0 mol·L-1碘的标准溶液滴定。
反应原理为2S2O +I2===S4O
+I2===S4O +2I-
+2I-
(5)滴定至终点时,溶液颜色的变化:____________________________________________。
(6)滴定起始和终点的液面位置如图,则消耗碘的标准溶液体积为__________mL。产品的纯度为(设Na2S2O3·5H2O相对分子质量为M)______________。

Ⅲ.Na2S2O3的应用
(7)Na2S2O3还原性较强,在溶液中易被Cl2氧化成SO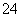 ,常用作脱氯剂,该反应的离子方程式为____________________________________________。
,常用作脱氯剂,该反应的离子方程式为____________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
在某100 mL混合酸中,HNO3的物质的量浓度为0.4 mol·L-1,H2SO4的物质的量浓度为0.2 mol·L-1,向其中加入2.56 g铜粉微热,待充分反应后,溶液中Cu2+的物质的量浓度约为( )
A.0.15 mol·L-1 B.0.3 mol·L-1 C.0.25 mol·L-1 D.无法计算
查看答案和解析>>
科目:高中化学 来源: 题型:
埋在地下的输油铸铁管道,在下列各种情况下被腐蚀速度最慢的是()
A. 在含铁元素较多的酸性土壤中
B. 在潮湿疏松透气的土壤中
C. 在干燥致密不透气的土壤中
D. 在含碳粒较多、潮湿透气的土壤中
查看答案和解析>>
科目:高中化学 来源: 题型:
以铁为阳极、以铜为阴极,对足量的NaOH溶液进行电解.一段时间后得到2molFe(OH)3沉淀,此时共消耗的水的物质的量为()
A. 2 mol B. 3 mol C. 4 mol D. 5 mol
查看答案和解析>>
科目:高中化学 来源: 题型:
石膏也可用于工业生产二氧化硫,进而生产硫酸。天然石膏的化学式为CaSO4·2H2O。将天然石膏脱水后,第2步化学反应就可制得二氧化硫。
(1)写出第1步反应的化学方程式__________________________________。
(2)在第2步化学反应中,下列原料可以使用的是(用序号填空)__________。
写出有关化学反应的方程式_________________________________________
_________________________________________________________________。
①空气 ②氧气 ③硫酸 ④焦炭
(3)在第2步化学反应中,可能会排入空气的气态污染物是________。它(或它
们)的主要危害是__________________________________________________
_________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
在200 mL某硫酸盐溶液中,含有1.5NA个硫酸根离子(NA表示阿伏加德罗常数的值),同时含有NA个金属离子。则该硫酸盐的物质的量浓度为 ( )
A.1 mol·L-1 B.2.5 mol·L-1
C.5 mol·L-1 D.2 mol·L-1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com