
(1)环境专家认为可以用金属铝将水体中的NO 转化为N2,从而清除污染。该反应中涉及的粒子有:H2O、Al、OH
转化为N2,从而清除污染。该反应中涉及的粒子有:H2O、Al、OH 、Al(OH)3、NO
、Al(OH)3、NO 、N2,写出反应的离子方程式 。
、N2,写出反应的离子方程式 。
(2)我国首创的海洋电池以海水为电解质溶液,电池总反应为:4Al+3O2+6H2O=4Al(OH)3。电池正极的电极反应式为 。
(3)已知:①4Al(s)+3O2(g)=2Al2O3(g) △H=-2834.9kJ/mol
②Fe2O3(s)+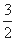 C(s)=
C(s)= 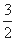 CO2(g)+2Fe(s) △H=+234.1kJ/mol
CO2(g)+2Fe(s) △H=+234.1kJ/mol
③C(s)+O2(g)=CO2(g) △H=-393.5kJ/mol
写出铝与氧化铁发生铝热反应的热化学方程式 。
(4)将一定质量的钠铝合金置于水中,合金全部溶解,得到20mol,pH=14的溶液,然后2mol/L盐酸滴定,可得沉淀质量与消耗的盐酸体积关系如下图: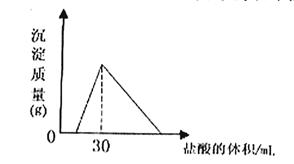 则反应过程中产生氢气的总体积为 L(标准状况)
则反应过程中产生氢气的总体积为 L(标准状况)
【知识点】离子方程式 反应热 电化学 计算 A 2B1 F3 F2
【答案解析】

解析:⑴根据金属铝将水体中的NO 转化为N2,及该反应中涉及的粒子有:H2O、Al、OH
转化为N2,及该反应中涉及的粒子有:H2O、Al、OH 、Al(OH)3、NO
、Al(OH)3、NO 、N2,知反应物有Al、NO
、N2,知反应物有Al、NO ,生成物有Al(OH)3、N2,并根据得失电子配平:6NO3-+10Al→10Al(OH)3+3N2,再根据电荷守恒知生成物还有OH
,生成物有Al(OH)3、N2,并根据得失电子配平:6NO3-+10Al→10Al(OH)3+3N2,再根据电荷守恒知生成物还有OH ,根据原子守恒知反应物还有水,6NO3-+10Al +18H2O=10Al(OH)3+3N2+6OH-
,根据原子守恒知反应物还有水,6NO3-+10Al +18H2O=10Al(OH)3+3N2+6OH-
⑵根据总反应4Al+3O2+6H2O=4Al(OH)3知电池正极的电极反应式为2H2O+O2+4e-=4OH-
⑶根据盖斯定律:①÷2+②-③×3/2得2Al(s)+Fe2O3(s)=2Fe(s)=2Fe(s)+Al2O3(s) △H=-593.1kJ/mol
⑷根据图像可知,盐酸加到30mL时,沉淀达最大,此时溶液中只有氯化钠,根据n(NaCl)=n(HCl)=0.06mol,则n(Na)=0.06mol,根据图像可知,氢氧化钠应该是过量的,过量的氢氧化钠是0.02L×1mol/L=0.02mol,则根据钠原子守恒知偏铝酸钠的物质的量为0.06mol-0.02mol=0.04mol,0.06mol钠与水反应生成氢气0.03mol,生成0.04mol的偏铝酸钠的同时生成氢气0.06mol,即生成氢气共0.09mol,为2.016L。
【思路点拨】氧化还原反应的配平技巧:如本题的第⑴题的配平:首先根据氧化还原反应得失电子相等配平氧化剂、还原剂、氧化产物和还原产物,再根据电荷守恒确定右边却OH-,最后根据原子守恒配平;根据终态法结合守恒解计算题:即本题的盐酸加到30mL时,沉淀达最大,此时溶液中只有氯化钠,然后根据守恒法解。


 开心快乐假期作业暑假作业西安出版社系列答案
开心快乐假期作业暑假作业西安出版社系列答案 名题训练系列答案
名题训练系列答案科目:高中化学 来源: 题型:
下列说法中,正确的是( )
A.芳香烃就是指苯和苯的同系物
B.通常可从煤焦油中或通过石油的催化重整来获取芳香烃
C.乙苯分子中所有原子可以处于同一平面上
D.苯和甲苯能发生取代反应但不能发生加成反应
查看答案和解析>>
科目:高中化学 来源: 题型:
1831年李比希提出了确定有机物中氢和碳的质量分数的方法,其基本原理是在高温下氧化有机物,其生成物主要是( )
A.CO和H2O B.CO和H2
C.CO2和H2O D.CO2和H2
查看答案和解析>>
科目:高中化学 来源: 题型:
某含氧有机化合物可以作为无铅汽油的抗爆震剂,其式量为88.0,含C的质量分数为0.682,含H的质量分数为0.136。
(1)试确定该化合物的分子式_____________________________________________________。
(2)经红外光谱和核磁共振氢谱显示该分子中有4个甲基,请写出其结构简式
________________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
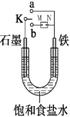
(Ⅰ)如图所示:
(1)若开始时开关K与a连接,则铁发生电化学腐蚀中的________腐蚀。
请写出正极反应式 。
(2)若开始时开关K与b连接时,两极均有气体产生,
则N端是电源的 极(填正或负)则总反应的离子方程式为 。
 |
(Ⅱ)用如图装置电解硫酸钾溶液来制取氧气、氢气、硫酸和氢氧化钾。
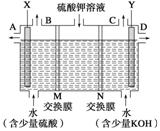
(1)X极与电源的_____(填“正”或“负”)极相连,氢气从_____(填“A、B、C或D”)口导出。
(2)已知离子交换膜只允许一类离子通过,则M为________(填“阴离子”或“阳离子”)交换膜。
(3)若制得标准状况下5.6 L氧气,则生成氢氧化钾的质量是____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列甲、乙、丙、丁各装置中发生的反应,有关说法正确的是
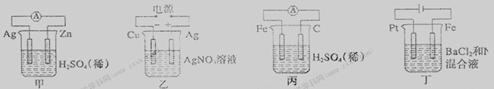
A.甲中负极反应式为2H++2e - =H2↑ B.乙中电解一段时间,溶液的质量会增重
C.丙中H+向碳棒方向移动 D.丁中电解开始时阴极产生黄绿色气体
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法正确的是
A.分散系中分散质粒子的直径:Fe(OH)3悬浊液> Fe(OH)3胶体> FeCl3溶液
B.能自发进行的化学反应,一定是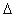 H<0、
H<0、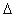 S>0
S>0
C.焰色反应是物质燃烧时火焰呈现的颜色变化,属于化学变化
D.钢铁发生电化学腐蚀时,负极的电极反应式为Fe-3e-= Fe3+
查看答案和解析>>
科目:高中化学 来源: 题型:
能正确表示下列反应的离子方程式是
A.用过量氨水吸收工业尾气中的SO2:2NH3·H2O+SO2=2NH4++SO32-+H2O
B.Ca(HCO3)2溶液与少量NaOH溶液反应:Ca2++2HCO3-+2OH-=CaCO3↓+CO32-+4H2O
C.磁性氧化铁溶于稀硝酸:Fe3O4+8H+=Fe2++2Fe3++4H2O
D.明矾溶液中滴入Ba(OH)2溶液使SO42-恰好完全沉淀:
2Ba2++3OH-+Al3++2SO42-=2BaSO4↓+Al(OH)3↓
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法中正确的是( )
A.平衡常数的大小不能反映化学反应可能进行的程度
B.K值越小,反应物的转化率越大
C.K值越大,反应物的转化率越大
D.温度越高,K值越大
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com