
NA为阿伏加德罗常数的值。下列说法正确的是( )
A.18 g D2O和18 g H2O中含有的质子数均为10NA
B.14 g CO、C2H4混合气体与11.2 L N2所含有的分子数都是0.5NA
C.过氧化钠与水反应时,生成0.1 mol氧气转移的电子数为0.2NA
D.密闭容器中2 mol NO与1 mol O2充分反应,产物的分子数为2NA
 一本好题口算题卡系列答案
一本好题口算题卡系列答案科目:高中化学 来源: 题型:实验题


查看答案和解析>>
科目:高中化学 来源:2017届吉林省高三上第二次模拟化学试卷(解析版) 题型:选择题
对相同状况下的12C18O和14N2两种气体,下列说法正确的是
A. 若质量相等,则质子数相等 B. 若原子数相等,则中子数相等
C. 若分子数相等,则体积相等 D. 若体积相等,则密度相等
查看答案和解析>>
科目:高中化学 来源:2017届广东省山一高三上第二次统测化学试卷(解析版) 题型:选择题
下列说法正确的是( )
A.投入铁片产生H2的溶液中可大量存在H+、Mg2+、SO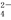 、NO
、NO
B.无色溶液中可能大量存在Al3+、NH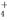 、Cl-、S2-
、Cl-、S2-
C.1.0 mol·L-1的KNO3溶液中可大量存在H+、Fe2+、Cl-、SO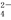
D.弱碱性溶液中可能大量存在Na+、K+、Cl-、HCO
查看答案和解析>>
科目:高中化学 来源:2016-2017学年云南省高一9月月考化学卷(解析版) 题型:填空题
有一瓶溶液只含Cl-、CO 、SO
、SO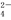 、Na+、Mg2+、Cu2+六种离子中的某几种.通过实验:
、Na+、Mg2+、Cu2+六种离子中的某几种.通过实验:
①原溶液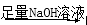 白色沉淀;
白色沉淀;
②原溶液中加BaCl2溶液不产生沉淀;
③原溶液中加AgNO3溶液产生白色沉淀,再加稀硝酸白色沉淀不溶解,回答下列问题:
(1)试分析原溶液中一定含有的离子是________,一定不含有的离子是________,可能含有的离子是________。
(2)有的同学认为实验③可以省略,你认为是否正确(填“是”或“否”)________,理由是_____________。
查看答案和解析>>
科目:高中化学 来源:2016-2017学年云南省高一9月月考化学卷(解析版) 题型:选择题
下列水溶液中的各组离子因为发生氧化还原反应而不能大量共存的是
A.Na+、Ba2+、Cl?、SO42-
B.Ca2+、HCO3?、C1?、K+
C.MnO4?、K+、I?、H+
D.H+ 、Cl? 、Na+ 、CO32?
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
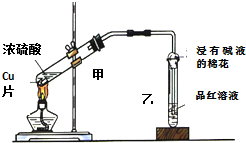 用如图装置做浓硫酸和铜反应的实验,实验过程中观察到甲试管底部有一些白色固体,乙试管中品红溶液褪色.
用如图装置做浓硫酸和铜反应的实验,实验过程中观察到甲试管底部有一些白色固体,乙试管中品红溶液褪色.查看答案和解析>>
科目:高中化学 来源: 题型:实验题
 运用所学知识,解决下列问题:
运用所学知识,解决下列问题:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com