
 △H=+88.6kJ/mol
△H=+88.6kJ/mol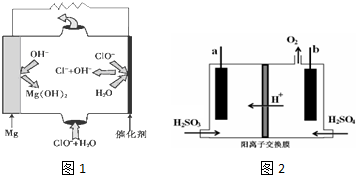
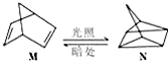
分析 (1)M转化为N是吸热反应,所以N的能量高,不稳定;
(2)①根据题目信息写出生成物,根据质量守恒配平;
②由图可知镁-次氯酸盐”燃料电池中Mg与ClO-、H2O反应生成Cl-与Mg(OH)2;
③依据电池反应阳极上是氢氧根离子失电子生成氧气的反应,b为阳极,a为阴极,亚硫酸在阴极被还原为硫单质;用总反应方程式减去阳极反应式可得阴极反应式.
解答 解:(1)有机物M经过太阳光光照可转化成N,:△H=+88.6kJ•mol-1,过程是吸热反应,N暗处转化为M,是放热反应,能量越低越稳定,说明M稳定;
故答案为:M;
(2)①用CO还原MgSO4可得到MgO、CO2、SO2和SO3,方程式为2MgSO4+CO=2MgO+SO2+CO2+SO3,
故答案为:2MgSO4+CO=2MgO+SO2+CO2+SO3;
②由图可知镁-次氯酸盐”燃料电池中Mg与ClO-、H2O反应生成Cl-与Mg(OH)2,该电池反应的总反应方程式为Mg+ClO-+H2O=Cl-+Mg(OH)2,正极电极反应是ClO-离子得到电子发生还原反应,电极反应为:ClO-+2e-+H2O=Cl-+2OH-,负极电极反应是Mg失去电子发生氧化反应,电极反应为:Mg-2e-+2OH-=Mg(OH)2,
故答案为:负;Mg+ClO-+H2O=Cl-+Mg(OH)2;
③依据电池反应阳极上是氢氧根离子失电子生成氧气的反应,电极反应式为:4OH--4e-=2H2O+O2↑b为阳极,a为阴极,亚硫酸在阴极被还原为硫单质;用总反应方程式减去阳极反应式可得阴极反应式为:4e-+H2O+H2SO3=S↓+4OH-,
故答案为:a;4e-+H2O+H2SO3=S↓+4OH-.
点评 本题考查的知识点较多,既考查了电化学又考查了反应热的问题,对学生综合运用知识能力有一定的要求,特别是根据图中信息写电极反应,要求学生有较好从图中获取信息的能力,整个题目难度较大.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| A | ①能使溴的四氯化碳溶液褪色; ②比例模型为:  ③能与水在一定条件下反应生成C |
| B | ①由C、H两种元素组成; ②球棍模型为: 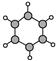 |
| C | ①由C、H、O三种元素组成; ②能与Na反应,但不能与NaOH溶液反应; ③能与E反应生成相对分子质量为100的酯. |
| D | ①相对分子质量比C少2; ②能由C氧化而成; |
| E | ①由C、H、O三种元素组成; ②球棍模型为: 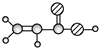 |
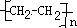 .
. .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 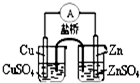 能组成Zn、Cu原电池 | B. |  能证明非金属性C>Si | ||
| C. | 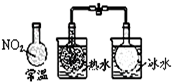 说明反应2NO2?N2O4△H>0 | D. | 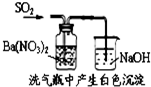 白色沉淀为BaSO4 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 离子键就是使阴、阳离子结合成化合物的静电引力 | |
| B. | 在化合物Na2O2中,阴、阳离子的个数比为1:1 | |
| C. | 在化合物CaCl2中,两个氯离子之间存在共价键 | |
| D. | 液态HCl不能导电,属于共价化合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 加入催化剂,平衡常数不变 | |
| B. | 减小容器体积,正反应速率增大、逆反应速率减小 | |
| C. | 增大CO(NH2)2的量,CO2的转化率减小 | |
| D. | 降低温度,平衡向逆反应方向移动 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | I的原子半径大于Br,HI比HBr的热稳定性强 | |
| B. | P的非金属性强于Si,H3PO4比H2SiO3的酸性强 | |
| C. | 锂所在周期元素最高价氧化物对应的水化物中,酸性最强的是HNO3 | |
| D. | 与水或者酸反应的剧烈程度:K>Na>Mg |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com