
 :
:
科目:高中化学 来源:不详 题型:单选题
| A.可与活泼金属直接发生化学反应 | B.易溶于水也易溶于NaOH溶液 |
| C.是一种有毒气体 | D.可用HCN溶液与MnO2混合加热制取 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:判断题
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.原子半径:W> Y> X |
| B.元素X与M形成化合物的空间构型可以是正四面体型、直线型或平面型等 |
| C.将X Z2通入W单质与水反应后的溶液中,生成的盐一定只有一种 |
| D.Y元素的含氧酸都属于强酸 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题

 反应中肯定不属于氧化还原反应的是 (填编号);
反应中肯定不属于氧化还原反应的是 (填编号);查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题

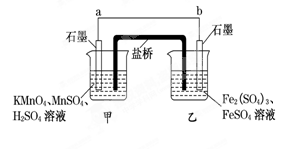
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
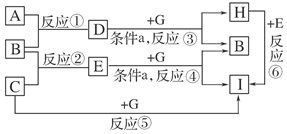
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
 要稀释为0.15mol/L的稀溶液480mL,需要的仪器除烧杯、玻璃棒、量筒、胶头滴管、还需要_________________。量取浓溶液的体积是______mL。在配置过程中如果定容时俯视刻度线,会造成所配溶液浓度________(填“偏高”、“偏低”或“无影响”,下同),如果实验完毕忘记洗涤量筒会造成所配溶液浓度_______。
要稀释为0.15mol/L的稀溶液480mL,需要的仪器除烧杯、玻璃棒、量筒、胶头滴管、还需要_________________。量取浓溶液的体积是______mL。在配置过程中如果定容时俯视刻度线,会造成所配溶液浓度________(填“偏高”、“偏低”或“无影响”,下同),如果实验完毕忘记洗涤量筒会造成所配溶液浓度_______。查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
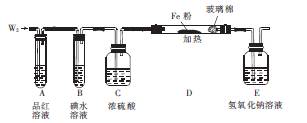
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com