
 +xI-+yH+=bNO↑+cI2+zH2O,请回答下列问题:
+xI-+yH+=bNO↑+cI2+zH2O,请回答下列问题: 的数值分别是 (全对才给分)。
的数值分别是 (全对才给分)。 2,该物质是 ,
2,该物质是 , 。
。 鸿图图书寒假作业假期作业吉林大学出版社系列答案
鸿图图书寒假作业假期作业吉林大学出版社系列答案科目:高中化学 来源:不详 题型:单选题
| A.60 mL | B.45 mL | C.30 mL | D.15 mL |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.NaOH | B.H2SO4 | C.CaCO3 | D.Na2SO4 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.氮族元素是位于周期表中第ⅤA族元素 |
| B.氮族元素的最高正价与最低负价的绝对值之差等于2 |
| C.硝酸是一种不稳定的强酸,具有强氧化性 |
| D.王水是浓硝酸和浓盐酸(体积比3﹕1)的混合物 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.2ω1 = ω2 | B.2ω2 = ω1 | C.ω2 > 2ω1 | D.ω1 < ω2 < 2ω1 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:计算题
 溶液与硫酸组成的混合溶液充分反应,反应过程中无任何气体放出,相反应后的溶液中逐滴加入4.00mol/L的NaOH溶液,加入的溶液体积与与产生的沉淀质量的关系如图所示。
溶液与硫酸组成的混合溶液充分反应,反应过程中无任何气体放出,相反应后的溶液中逐滴加入4.00mol/L的NaOH溶液,加入的溶液体积与与产生的沉淀质量的关系如图所示。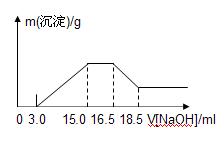
 /L
/L 查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
 KIO3 +3H2↑。
KIO3 +3H2↑。查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
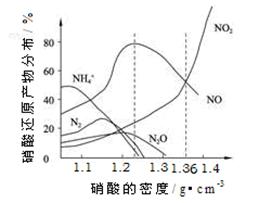
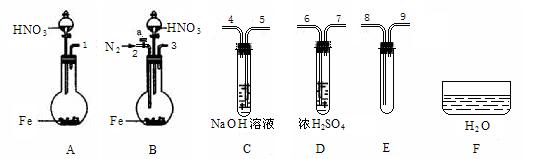
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com