
【题目】右图为以惰性电极进行电解:
(1)写出A、B、C、D各电极上的电极反应式和总反应方程式:
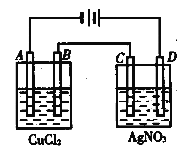
A:________________,B:__________________,总反应方程式:________________________;C:________________________________,D:________________________________,总反应方程式:___________________________;
(2)在A、B、C、D各电极上析出生成物的物质的量比为__________________。
【答案】 Cu 2+ +2e - = Cu 2Cl - -2e-=Cl 2 ↑ CuCl 2![]() Cu+ Cl 2 ↑ 4Ag + +4e - =4Ag 4OH - -4e - =2H 2 O+O 2 ↑ 4AgNO 3 +2H 2 O
Cu+ Cl 2 ↑ 4Ag + +4e - =4Ag 4OH - -4e - =2H 2 O+O 2 ↑ 4AgNO 3 +2H 2 O![]() Ag+O 2 ↑+4HNO 3 2:2:4:1
Ag+O 2 ↑+4HNO 3 2:2:4:1
【解析】(1)A极连接电源的负极,A是阴极,溶液中的铜离子放电,电极反应式是Cu2++2e-= Cu,B是阳极,溶液中的氯离子放电,电极反应式是2Cl--2e-=Cl2↑;所以总反应方程式是CuCl2![]() Cu+ Cl2↑;D电极和电源的正极相连,所以D电极是阳极,溶液中的OH-放电,电极反应式是4OH--4e-=H2O+O2↑;C是阴极,溶液中的银离子放电,电极反应式是4Ag++4e-=4Ag,总反应方程式是4AgNO3+2H2O
Cu+ Cl2↑;D电极和电源的正极相连,所以D电极是阳极,溶液中的OH-放电,电极反应式是4OH--4e-=H2O+O2↑;C是阴极,溶液中的银离子放电,电极反应式是4Ag++4e-=4Ag,总反应方程式是4AgNO3+2H2O![]() Ag+O2↑+4HNO3; (2)根据电子的得失守恒(可以根据上述电极反应式中各物质分别得失电子数相等时的电极产物计算)可知,在A、B、C、D各电极上析出生成物的物质的量比为2︰2︰4︰1。
Ag+O2↑+4HNO3; (2)根据电子的得失守恒(可以根据上述电极反应式中各物质分别得失电子数相等时的电极产物计算)可知,在A、B、C、D各电极上析出生成物的物质的量比为2︰2︰4︰1。


科目:高中化学 来源: 题型:
【题目】在一密闭容器中加入A和B,各物质的物质的量浓度随着反应的进行,如图所示.下列说法不正确的是( ) 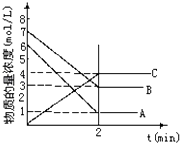
A.该反应的化学方程式为5A+4B4C
B.2min时,该反应达到平衡,此时A,B,C的浓度比为5:4:4
C.用B的浓度变化表示2min内的速率为2mol/(Lmin)
D.2min前,正反应速率逐渐减小,逆反应速率逐渐增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫酸亚锡(SnSO4)是一种重要的硫酸盐,广泛应用于镀锡工业。某研究小组设计SnSO4制备路线如下:

查阅资料:Ⅰ.酸性条件下,锡在水溶液中有Sn2+、Sn4+两种主要存在形式,Sn2+易被氧化。
Ⅱ.SnCl2易水解生成碱式氯化亚锡。(Sn: 119)
回答下列问题:
(1) 操作Ⅰ是________、过滤洗涤。
(2)SnCl2粉末需加浓盐酸进行溶解,目的是_______________________________。
(3)加入Sn粉的作用有两个:①调节溶液pH,②____________________________。[
(4)反应Ⅰ得到沉淀是SnO,得到该沉淀的离子反应方程式是___________________。
(5)该小组通过下列方法测定所用锡粉的纯度(杂质不参与反应):
①将试样溶于盐酸中,发生的反应为:Sn + 2HCl![]() SnCl2+ H2↑;
SnCl2+ H2↑;
②加入过量的FeCl3;
③用已知浓度的K2Cr2O7滴定生成的Fe2+,发生的反应为:
6FeCl2+ K2Cr2O7+ 14HCl![]() 6FeCl3+ 2KCl + 2CrCl3+7H2O
6FeCl3+ 2KCl + 2CrCl3+7H2O
现取0.80 g锡粉,经上述各步反应后,共用去0.1000 mol/L K2Cr2O7溶液20.00mL。则锡粉中锡的纯度为_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某无色溶液能与铝片作用生成氢气,则溶液中一定能大量共存的离子组是( )
A. Ca2+、Cu2+、Cl- B. Mg2+、Ba2+、NO3-
C. Cl-、K+、SO42- D. CO32-、Cl-、Mg2+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在2L的密闭容器中,发生以下反应:2A(g)+ B(g) ![]() 2C(g)+D(g) 。若最初加入的A和B都是4 mol,在前10秒钟A的平均反应速度为0.12 mol/(L·s),则10秒钟时,容器中B的物质的量是( )
2C(g)+D(g) 。若最初加入的A和B都是4 mol,在前10秒钟A的平均反应速度为0.12 mol/(L·s),则10秒钟时,容器中B的物质的量是( )
A. 1.6 mol B. 2.8 mol C. 2.4 mol D. 1.2 mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在不同温度下,水溶液中c(H+)与c(OH-)有如图所示关系。
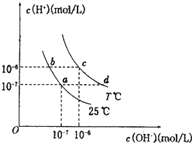
下列条件关于离子共存说法中正确的是
A. d点对应的溶液中大量存在:Na+、K+、S2-、SO32-
B. b点对应的溶液中大量存在:NH4+、K+、I-、NO3-
C. c点对应的溶液中大量存在:Na+、Fe3+、SO42-、Cl-
D. a点对应的溶液中大量存在:Fe2+、Ca2+、ClO-、SO42-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列可以一次性鉴别氯化钾、盐酸、氢氧化钠三种溶液的试剂是( )
A. 紫色石蕊试液 B. AgNO3溶液 C. Na2CO3溶液 D. BaCl2溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】亚硝酸钙是一种阻锈剂,可用于染料工业,某兴趣小组拟制备Ca(NO2)2并对其性质进行探究。
【背景素材】
Ⅰ.NO+NO2+Ca(OH)2Ca(NO2)2+H2O。
Ⅱ.Ca(NO2)2能被酸性KMnO4溶液氧化成![]() ,
, ![]() 被还原为Mn2+。
被还原为Mn2+。
Ⅲ.在酸性条件下,Ca(NO2)2能将I氧化为I2, ![]() 能将I2还原为I。
能将I2还原为I。
【制备氮氧化物】
(1)甲组同学拟利用如下图所示装置制备氮氧化物。
![]()
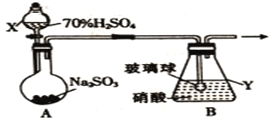
①仪器X的名称是_______________,在制备氮氧化物前要先____________________________。
②装置B中逸出的NO与NO2的物质的量之比为1∶1,则装置B中发生反应的化学方程式为____________________________________________________,若其他条件不变,增大硝酸的浓度,则会使逸出的气体中n(NO2)__________n(NO)(填“>”或“<”)。
【制备Ca(NO2)2】
(2)乙组同学拟利用装置B中产生的氮氧化物制备Ca(NO2)2,装置如图。
![]()
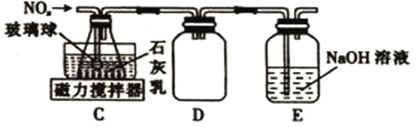
①装置C中导管末端接一多孔玻璃球的作用是______________________________________。
②装置D的作用是_______________________;装置E的作用是______________________。
【测定Ca(NO2)2的纯度】
(3)丙组同学拟用滴定法测定Ca(NO2)2的纯度(杂质不参加反应),可供选择的试剂:
a.稀硫酸 b.c1 mol·L1的KI溶液 c.淀粉溶液
d.c2 mol·L1的Na2S2O3溶液 e.c3 mol·L1的酸性KMnO4溶液
①利用Ca(NO2)2的还原性来测定其纯度,可选择的试剂是________________(填字母)。
②利用Ca(NO2)2的氧化性来测定其纯度的步骤:准确称取m g Ca(NO2)2样品放入锥形瓶中,加适量水溶解,加入______________________________,然后滴加稀硫酸,用c2 mol·L1的Na2S2O3溶液滴定至溶液颜色由________________________,且半分钟内不变色,读取消耗Na2S2O3溶液的体积。为减少误差,须__________________________________________(请补充完整实验步骤)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com