
| A、在配制牛肉膏蛋白胨固体培养基时,需加入琼脂,不需要添加NaCl |
| B、利用DNA在不同浓度的NaCl溶液中的溶解度不同,粗提取DNA |
| C、在腐乳制作过程中,装瓶时需逐层等量加入NaCl,以防杂菌污染 |
| D、将哺乳动物的成熟红细胞浸泡于0.9%的NaCl溶液中,用以制备纯净的细胞膜 |


科目:高中化学 来源: 题型:
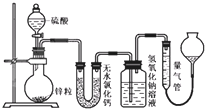 不同浓度的硫酸与锌反应时,产物不同,为了验证这一事实,某同学拟用如图装置进行实验(假设实验条件为压强为101kPa,温度为0℃).
不同浓度的硫酸与锌反应时,产物不同,为了验证这一事实,某同学拟用如图装置进行实验(假设实验条件为压强为101kPa,温度为0℃).查看答案和解析>>
科目:高中化学 来源: 题型:
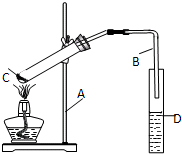 实验室制乙酸乙脂的装置如图:
实验室制乙酸乙脂的装置如图:查看答案和解析>>
科目:高中化学 来源: 题型:
| A、在蒸发皿中,用酒精灯加热蒸发NaHCO3溶液,可以得到NaHCO3固体 |
| B、用丁达尔现象可以区分食盐水和淀粉溶液 |
| C、在酸碱中和滴定实验中,锥形瓶要用待测溶液润洗 |
| D、欲配置1.0L 1.00 mol?L-1的NaCl溶液,可将58.5g NaCl溶于1.00L水中 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、使用、制备有毒气体应在通风橱中进行,应有完全吸收处理装置 |
| B、酒精及其它易燃物小面积失火,应该迅速使用湿抹布扑盖;钠、钾等失火应用泡沫灭火器扑灭 |
| C、汞洒落后,应立即撤上硫粉,并打开墙下面的排气扇 |
| D、学生实验时应戴防护眼镜,万一眼睛中溅进酸或碱溶液,应立即用水冲洗(切忌不要用手揉眼睛),然后请医生处理 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、n=m+17Vc | ||||
B、c=
| ||||
C、p=m+
| ||||
D、
|
查看答案和解析>>
科目:高中化学 来源: 题型:
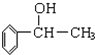 所示:
所示:查看答案和解析>>
科目:高中化学 来源: 题型:
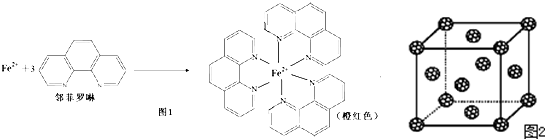
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com