
分析 把电子层数相同的各种元素按原子序数递增的顺序从左至右排成横行称为周期,把最外层电子数相同的元素按电子层数递增的顺序由上到下排列成纵行称为族,元素周期表共有18个纵行,16个族,七个周期,周期表中1、2、3为短周期,4、5、6为长周期,第7周期为不完全周期.
解答 解:元素周期表有七个横行共有七个周期,其中1、2、3周期称为短周期,4、5、6、7周期称为 长周期,其中第七周期尚未填满,又可称作不完全周期.元素周期表中共有 18个纵列,其中第8、9、10三个纵列称为第Ⅷ族,第18纵列由稀有气体元素组成,稀有气体元素的化学性质不活泼,化合价通常为0,因而这一族称为0族元素,
故答案为:七;短;长;七;18; 第Ⅷ族; 0;0族元素.
点评 本题考查了元素周期表的结构,题目难度不大,侧重于基础知识的考查,注意把握周期和族的编排依据.


科目:高中化学 来源: 题型:选择题
| 选项 | 实验操作 | 实验目的或结论 |
| A | 在少量无水乙醇中加入金属Na,缓慢生成可以在空气中燃烧的气体 | CH3CH2OH是弱电解质 |
| B | 将SO2气体通入紫色石蕊溶液中,观察溶液颜色的变化 | 能证明SO2具有漂白性 |
| C | 向2mL1mol•L-1NaOH溶液中先加入0.2mL1mol•L-1FeCl3溶液,再加入0.2mL1mol•L-1MgCl2溶液 | 证明Ksp[Mg(OH)2]>Ksp[Fe(OH)3] |
| D | 向2mL品红溶液和2mL加入少许醋酸的品红溶液中分别滴入3滴“84”消毒液,观察红色褪色的快慢 | 证明溶液pH的减少,“84”消毒液的氧化能力增强 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
| ① | ||||||
| ② | ③ | ④ | ||||
| ⑤ | ⑥ | ⑦ | ⑧ |
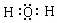 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ${\;}_{8}^{18}$O与${\;}_{8}^{16}$O是中子数相同 | B. | ${\;}_{8}^{18}$O与${\;}_{8}^{16}$O互为同位素 | ||
| C. | ${\;}_{8}^{18}$O和${\;}_{8}^{16}$O化学性质不相同 | D. | ${\;}_{8}^{18}$O和${\;}_{8}^{16}$O互为同素异形休 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
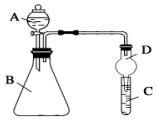 某同学为探究元素周期表中元素性质的递变规律,设计了如下系列实验.
某同学为探究元素周期表中元素性质的递变规律,设计了如下系列实验.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
| 物质 | MgO | Al2O3 | MgCl2 | AlCl3 |
| 熔点/℃ | 2 852 | 2 072 | 714 | 190(2.5×105 Pa) |
| 沸点/℃ | 3 600 | 2 980 | 1 412 | 182.7 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
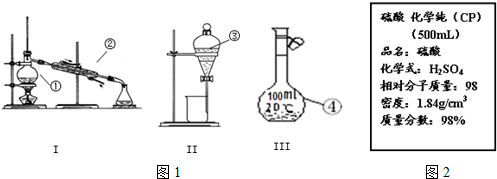
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com