
A.氯水中有下列平衡:Cl2+H2O HCl + HClO,当加入AgNO3溶液后,溶液颜色变浅 HCl + HClO,当加入AgNO3溶液后,溶液颜色变浅 |
B.对2HI(g)  H2(g)+I2(g),平衡体系增大压强可使颜色变深 H2(g)+I2(g),平衡体系增大压强可使颜色变深 |
C.反应CO+NO2  CO2+NO(正反应为放热反应),升高温度可使平衡向逆反应方向移动 CO2+NO(正反应为放热反应),升高温度可使平衡向逆反应方向移动 |
D.合成NH3反应,为提高NH3的产率,理论上应采取低温度的措施(N2+3H2 2NH3;DH<0) 2NH3;DH<0) |
科目:高中化学 来源:不详 题型:填空题
 CO(g)+H2(g);ΔH= ▲ 。(用含ΔH1、ΔH2的代数式表示)
CO(g)+H2(g);ΔH= ▲ 。(用含ΔH1、ΔH2的代数式表示) CH3OH(g);ΔH3。现在容积均为1L的a、b、c、d、e五个密闭容器中分别充入1mol CO和2mol H2的混合气体,控温,进行实验,测得相关数据如下图1和图2。
CH3OH(g);ΔH3。现在容积均为1L的a、b、c、d、e五个密闭容器中分别充入1mol CO和2mol H2的混合气体,控温,进行实验,测得相关数据如下图1和图2。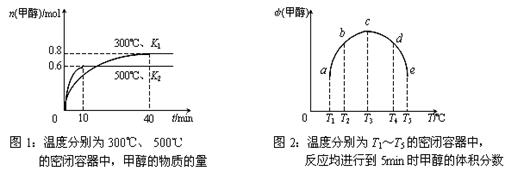
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
 N2O4 ( g ) 已达到平衡,缩小此密闭容器的容积,则混合气体颜色的变化是
N2O4 ( g ) 已达到平衡,缩小此密闭容器的容积,则混合气体颜色的变化是| A.变深 | B.变浅 | C.先变深再稍变浅 | D.先变浅再稍变深 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
 CH3CH2OH(g)+3H2O(g)。
CH3CH2OH(g)+3H2O(g)。 温度(K) 温度(K)CO2转化率(%) n(H2)/n(CO2) | 500 | 600 | 700 | 800 |
| 1.5 | 45 | 33 | 20 | 12 |
| 2 | 60 | 43 | 28 | 15 |
| 3 | 83 | 62 | 37 | 22 |
 CH3OH(g)+H2O(g)。2min末该反应达到平衡,测得CH30H的浓度为0.2mol/L。下列判断不正确的是___ _。
CH3OH(g)+H2O(g)。2min末该反应达到平衡,测得CH30H的浓度为0.2mol/L。下列判断不正确的是___ _。

 溶液与Na2CO3溶液混合可形成CaCO3沉淀,现将等体积的CaCl2溶液与Na2CO3溶液混合,若Na2CO3溶液的浓度为
溶液与Na2CO3溶液混合可形成CaCO3沉淀,现将等体积的CaCl2溶液与Na2CO3溶液混合,若Na2CO3溶液的浓度为 ,则生成沉淀所需CaCl2溶液的最小浓度为 。
,则生成沉淀所需CaCl2溶液的最小浓度为 。查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
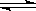 CH3OH(g)。
CH3OH(g)。
 大”、“不变”或“减小”)
大”、“不变”或“减小”) 增大的有 。
增大的有 。| A.升高温度 | B.充入He气 |
| C.再充入1molCO和2molH2 | D.使用催化剂 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
 xC(g),①向甲中通入4 mol A、2 mol
xC(g),①向甲中通入4 mol A、2 mol  B,达平衡时测得其中C的体积分数为40%;②向乙中通入1 mol A、0.5 mol B和3 mol C,平衡时测得C的体积分数为W%。试回答:
B,达平衡时测得其中C的体积分数为40%;②向乙中通入1 mol A、0.5 mol B和3 mol C,平衡时测得C的体积分数为W%。试回答:查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
 2SO3达到平衡状态的标志是
2SO3达到平衡状态的标志是| A.容器中SO2、O2、SO3的分子数之比为2﹕1﹕2 |
| B.单位时间内生成nmol SO3,同时消耗n/2mol O2 |
| C.容器内的压强不随时间而变化 |
| D.生成SO3和生成O2的速率相同 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
 N2O4(g),达平衡时,再向容器内通入一定量的NO2(g),重达平衡后,与第一次平衡时相比,NO2的体积分数( )
N2O4(g),达平衡时,再向容器内通入一定量的NO2(g),重达平衡后,与第一次平衡时相比,NO2的体积分数( )| A.不变 | B.增大 | C.减小 | D.无法判断 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.加入催化剂有利于氨的氧化反应 |
| B.氢硫酸中加碱有利于S2-离子的增多 |
| C.在60℃左右比在室温更有利于FeCl3的水解 |
| D.高压条件更有利于合成氨反应 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com