
| A. | ②④ | B. | ②③④ | C. | ①②④ | D. | ②④⑤ |
分析 ①氧化剂化合价降低得电子;
②氧化剂得电子具有氧化性;
③某元素在反应中由化合物转化为单质,该元素的化合价可能升高,也可能降低;
④存在元素化合价变化的反应是氧化还原反应;
⑤还原性与失电子能力有关.
解答 解:①氧化还原反应中所含有元素化合价降低的物质为氧化剂,氧化剂化合价降低得电子,发生还原反应,故错误;
②氧化剂在反应中元素的化合价降低,得电子,具有氧化性,故正确;
③某元素在反应中由化合物转化为单质,该元素的化合价可能升高,也可能降低,元素可能被氧化,如Cl-→Cl2,也可能被还原,如Cu2+→Cu,故错误;
④存在元素化合价变化的反应是氧化还原反应,所以物质所含元素化合价变化是判断氧化还原反应的依据,故正确;
⑤还原性与失电子能力有关,与失电子数多少无关,越易失电子,还原性越强,故错误.
故选A.
点评 本题考查氧化还原反应,题目难度不大,本题注意从化合价的角度分析氧化还原反应,注意常见物质的性质,侧重氧化还原反应基本概念的考查.


科目:高中化学 来源: 题型:解答题
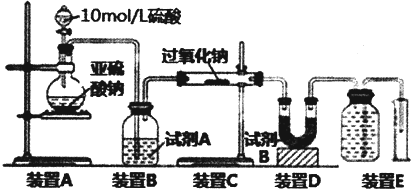
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 乙酸丁酯沸点、溶解性如下表.
乙酸丁酯沸点、溶解性如下表.| 物质 | 乙酸 | 1-丁醇 | 乙酸丁酯 | 90%浓硫酸 |
| 沸点 | 117.9℃ | 117.2℃ | 126.3℃ | 338.0℃ |
| 溶解性 | 溶于水和有机溶剂 | 溶于水和有机溶剂 | 微溶于水,溶于有机溶剂 | 与水混溶 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氯化钠水溶液在电流的作用下电离出Na+和Cl- | |
| B. | 硫酸钡难溶于水,但硫酸钡属于强电解质 | |
| C. | 二氧化碳溶于水能部分电离,故二氧化碳属于弱电解质 | |
| D. | 硫酸氢钠在水中的电离方程式可表示为NaHSO4═Na++HSO4- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 等物质的量N2和CO2中,共用电子对的个数比为3:4 | |
| B. | 该反应中化合价变化的有N和C元素 | |
| C. | 氧化剂与还原剂的物质的量之比为1:1时,NOx中氮元素的化合价为+2价 | |
| D. | 当x=2时,每生成1mol N2,转移电子数为4mol |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1molNaCl固体溶于1L水所得溶液中NaCl的物质的量浓度为1mol•L-1 | |
| B. | 2.3g钠转化为钠离子时得到的电子数目为0.1NA | |
| C. | 常温常压下,11.2L 甲烷中所含的氢原子数为2NA | |
| D. | 32g O2和O3混合气体所含的原子数目为2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NaNO2发生的是氧化反应 | B. | 生成1molN2时转移的电子数为3mol | ||
| C. | NH4Cl中的N元素被还原 | D. | N2既是氧化剂有事还原剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
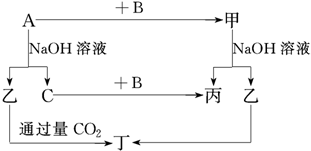
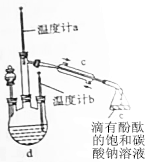
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 强电解质:盐酸、氢氧化钡、明矾 | |
| B. | 纯净物:冰水混合物;含氧40%的氧化镁 | |
| C. | 有单质参加和单质生成的化学反应一定是氧化还原反应 | |
| D. | 同位素:H2、D2、T2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com