
(14分)废旧碱性锌锰干电池内部的黑色物质A主要含有MnO2、NH4CI、ZnCI2,还有少量的FeCI2和炭粉,用A制备高纯MnCO3,的流程图如下。

(1)碱性锌锰干电池的负极材料是_________(填化学式)。
(2)第Ⅱ步操作的目的是________________________。
(3)第Ⅳ步操作是对滤液a进行深度除杂,除去Zn2+的离子方程式为____________________。
(已知:Ksp(MnS)=2.5×10-13,Ksp(ZnS)=1.6×10-24)
(4)为选择试剂X,在相同条件下,分别用5 g 黑色物质M进行制备MnSO3的实验,得到数据如右表:
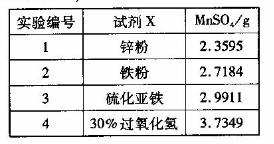
①试剂x的最佳选择是_________。
②第Ⅲ步中用选出的最佳试剂X与M的主要成分反应的化学方程式为_________。
(5)已知:MnCO3难溶于水和乙醇,潮湿时易被空气氧化,100℃开始分解;Mn(OH)2开始沉淀时pH为7.7。请补充完成以下操作:
第Ⅴ步系列操作可按一下流程进行:请补充完成操作:(第Ⅴ步系列操作中可供选用的试剂: 、乙醇)
、乙醇)
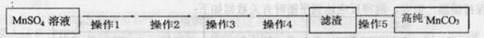
操作1:___________________;操作2:过滤,用少量水洗涤2~3次
操作3:检测滤液,表明SO42-已除干净; 操作4:___________________;
操作5:低温烘干。
(6)操作1可能发生反应的离子方程式
(14分,每空2分)
(1)Zn
(2)除去碳粉
(3)Zn2++MnS=ZnS+Mn2+
(4)①30%的过氧化氢 ②H2O2+MnO2+H2SO4=MnSO4+2H2O+O2↑
(5)加入NaHCO3,控制pH<7.7; 用少量无水乙醇洗涤2~3次
(6)Mn2++2 HCO3-= MnCO3↓+H2O+CO2↑
【解析】
试题分析:(1) 碱性锌锰干电池中,锌比锰活泼,所以负极材料是Zn;
(2)第I步操作水浸后,溶于水的NH4CI、ZnCI2可除去,而碳粉不溶于水,所以第Ⅱ步操作的目的是除去碳粉;
(3)第Ⅳ步操作中加入MnS目的是利用沉淀的转化除去Zn2+,使MnS转化为更难溶的ZnS,离子方程式为Zn2++MnS=ZnS+Mn2+
(4)①根据表中数据选择30%的过氧化氢得到的MnSO4的质量最多,所以选择30%的过氧化氢;
②根据表可知,过氧化氢是把二氧化锰转化为硫酸锰,本身被氧化为氧气,化学方程式为H2O2+MnO2+H2SO4=MnSO4+2H2O+O2↑
(5)最终产物是碳酸锰,所以第一步应加入NaHCO3,调节pH值使之小于7.7,防止氢氧化锰生成;MnCO3潮湿时易被空气氧化,所以水洗完后再用用少量无水乙醇洗涤2~3次以除去碳酸锰表面的水分;
(6)操作1目的是生成碳酸锰的沉淀,所以可能发生反应的离子方程式Mn2++2 HCO3-= MnCO3↓+H2O+CO2↑
考点:考查原电池中电极的判断,理解应用题目中信息的能力,化学方程式的判断及书写


 阳光课堂同步练习系列答案
阳光课堂同步练习系列答案科目:高中化学 来源:2013-2014北京市大兴区高三统一练习理综化学试卷(解析版) 题型:简答题
( 14分) 某化学小组进行Na2O2与水反应的实验,如下图所示,该小组对试管c中红色褪去的原因进行探究。

(1)Na2O2中含有的化学键类型: ;请写出a中反应的化学方程式 。
查阅资料:
①当NaOH溶液pH≥13时,可以使酚酞由红色褪为无色;
②Na2O2与水反应分两步进行:Na2O2 + H2O = NaOH + H2O2 2H2O2 = 2H2O + O2↑
(2)请设计实验验证Na2O2与水反应后的溶液中有H2O2残留:取少量b溶液于试管中, ,证明溶液中有H2O2残留。
(3)结合资料,该小组同学针c中溶液红色褪去的原因提出以下假设:
① ;
② 溶液中H2O2破坏酚酞的结构;
③ NaOH和H2O2共同作用结果。
(4)该小组同学测出c中溶液的pH为14,认为还不能排除假设②、③,于是又进行了如下实验,请完成下表空白处:
实验 | 操作 | 现象 | 结论 |
1 | 向少量H2O2中滴加2滴酚酞,放置一段时间,再加入NaOH溶液至pH=12 | 加入NaOH后,无色溶液先变红,后褪色 | ①
|
2 | 向少量 NaOH溶液(pH=14)中滴加2滴酚酞;再加适量稀盐酸至溶液 pH=12 | 溶液先变红,后褪色;加盐酸后,又出现红色,且不褪色 | |
3 | 向Na2O2与水反应后的溶液(pH=14)中滴加2滴酚酞;再加适量稀盐酸至溶液 pH=12 …… |
② …… | 溶液pH大于13时,NaOH使变红的溶液褪色;pH在8~13时, NaOH和H2O2共同作用使溶液褪色 |
(5)某同学按取(4)中述实验2褪色后的溶液,加水稀释至pH=12,没有观察到溶液变红。该同学推测实验2加盐酸后溶液变红还可能与温度有关,请写出理由: 。
查看答案和解析>>
科目:高中化学 来源:2013-2014北京市东城区高三二模理综化学试卷(解析版) 题型:选择题
下列离子方程式不正确的是
A. 向AgCl悬浊液中加入Na2S溶液:2AgCl +S2- == Ag2S+ 2Cl-
B. 向NaHCO3溶液中加入NaOH溶液: HCO3-+OH- == + H2O
C. 向Ba(OH)2溶液中加入稀H2SO4:Ba2+ + OH- + H+ + == BaSO4↓+ H2O
D. 向Cu粉中加入过量的浓HNO3:Cu+4H+ +2== Cu2++2NO2↑+2H2O
查看答案和解析>>
科目:高中化学 来源:2013-2014内蒙古鄂尔多斯市高一下学期期末质量检测化学试卷(解析版) 题型:选择题
2014年4月10日,兰州发生自来水苯含量超标事件。苯是石油化工的基本原料,苯进入人体内,可在造血组织本身形成有血液毒性的代谢产物,被世界卫生组织认定为致癌物质。下列关于苯的叙述正确的是
A.苯环是单、双键交替组成的平面环状结构
B.苯和乙烯均能使酸性KMnO4溶液褪色
C.苯的硝化反应:属于取代反应

D.苯跟溴水在催化剂作用下发生取代反应生成溴苯
查看答案和解析>>
科目:高中化学 来源:2013-2014内蒙古鄂尔多斯市高一下学期期末质量检测化学试卷(解析版) 题型:选择题
化学实验应与化工生产一样遵循绿色化学的原则,实现原料和过程绿色化。下列操作符合绿色化学原则的是
A.为便于观察铜在氯气中燃烧的现象,加大氯气的使用量
B.实验室改用H2O2和MnO2反应,代替加热KClO3和MnO2制取氧气
C.焚烧塑料、橡胶等废弃物是处理城市生产、生活垃圾的有效方法
D.制取CuSO4: Cu+2H2SO4(浓)  CuSO4+SO2↑+2H2O
CuSO4+SO2↑+2H2O
查看答案和解析>>
科目:高中化学 来源:2013-2014内蒙古赤峰市高三下学期4月统一考试理综化学试卷(解析版) 题型:填空题
有机物X的蒸气相对氢气的密度为51,X中氧元素的质量分数为31.7%,则能在碱性溶液中发生反应的X的同分异构体有(不考虑立体异构)( )
A.15种 B.14种 C.13种 D.12种
查看答案和解析>>
科目:高中化学 来源:2013-2014内蒙古赤峰市年宁城县高三5月模拟考试理综化学试卷(解析版) 题型:填空题
(14分)二氧化钛广泛应用于各类结构表面涂料、纸张涂层等,二氧化钛还可作为制备钛单质的原料。
Ⅰ.二氧化钛可由以下两种方法制备:
方法1:TiCl4水解生成TiO2·xH2O,过滤、水洗除去其中的Cl-,再烘干、焙烧除去水分得到粉体TiO2,此方法制备得到的是纳米二氧化钛。
(1)①TiCl4水解生成TiO2·xH2O的化学方程式为 。
②检验TiO2·xH2O中Cl-是否被除净的方法是 。
方法2:可用含有Fe2O3的钛铁矿(主要成分为FeTiO3,其中Ti元素化合价为+4价)制取,其主要流程如下:

(2)Fe2O3与H2SO4反应的离子方程式是 。
(3)甲溶液中除含TiO2+之外还含有的金属阳离子有 。
(4)加Fe的作用是 。
Ⅱ、二氧化钛可用于制取钛单质
(5)TiO2制取单质Ti,涉及到的步骤如下:
TiO2 TiCl4
TiCl4 Ti
Ti
反应②的方程式是 ,该反应需要在Ar气氛中进
行,请解释原因: 。
查看答案和解析>>
科目:高中化学 来源:2013-2014云南省红河州高三下学期毕业生复习统一检测理综化学试卷(解析版) 题型:选择题
常温下,下列各组离子在指定溶液中一定能大量共存的是
A.溶液中由水电离的氢离子浓度为1×10-11 mol/L:K+、Na+、SO42- 、NO3-
B.使酚酞变红色的溶液:Na+、Cu2+、HCO3- 、NO3-
C.0. 1 mol·L-1AgNO3 溶液:H+、K+、SO42- 、I-
D.0. 1 mol·L-1NaAlO2 溶液: H+、Na+、Cl-、SO42-
查看答案和解析>>
科目:高中化学 来源:2013-2014云南省高三5月校统测理科综合化学试卷(解析版) 题型:选择题
咖啡酸可用作化学原料和中间体,其结构如图。下列关于咖啡酸说法不正确的是

A.能发生加聚反应
B.能使高锰酸钾酸性溶液褪色
C.1 mol咖啡酸最多能与3 mol NaOH反应
D.1 mol咖啡酸最多能与 3 mol Br2反应
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com