
【题目】某同学应用如图所示装置研究气体的性质.现有某气体,其主要成分是氯气,还含有少量空气和水蒸气,请回答:
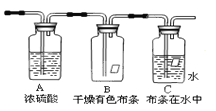
(1)实验室用二氧化锰和浓盐酸制取氯气____________(写化学方程式),该实验研究的主要目的是 。浓硫酸的作用是 。
(2)B、C中能观察到的实验现象是
B中 ;
C中 .
(3)氯水里面含有较多成分,氯水呈黄绿色,起作用的是 ,将紫色石蕊溶液滴入氯水中,氯水显红色,过一会儿,红色消失,起作用的成分是 。
【答案】(1)MnO2+4HCl(浓)![]() MnCl2+2H2O+Cl2↑;探究氯气具有漂白性的条件;干燥氯气
MnCl2+2H2O+Cl2↑;探究氯气具有漂白性的条件;干燥氯气
(2)有色布条不褪色;有色布条褪色(3)Cl2;HClO
【解析】
试题分析:(1)实验室用二氧化锰和浓盐酸制取氯气的化学方程式为MnO2+4HCl(浓)![]() MnCl2+2H2O+Cl2↑;根据装置图考点该实验研究的主要目的是探究氯气具有漂白性的条件。生成的氯气中含有水蒸气,所以浓硫酸的作用是干燥氯气。
MnCl2+2H2O+Cl2↑;根据装置图考点该实验研究的主要目的是探究氯气具有漂白性的条件。生成的氯气中含有水蒸气,所以浓硫酸的作用是干燥氯气。
(2)氯气没有漂白性,与水反应生成的次氯酸具有漂白性,所以B中的实验现象是有色布条不褪色;C中的实验现象是有色布条褪色;
(3)氯水里面含有较多成分,氯水呈黄绿色,起作用的是Cl2,将紫色石蕊溶液滴入氯水中,氯水显红色,过一会儿,红色消失,次氯酸具有强氧化性,所以起作用的成分是HClO。


科目:高中化学 来源: 题型:
【题目】25℃时,下列各组离子在指定溶液中一定能大量共存的是( )
A. 在强碱性溶液中:Na+、K+、AlO2﹣、Cl﹣
B. pH=l的溶液中:HCO3﹣、NH4+、NO3﹣、Ca2+
C. 无色溶液中:Cu2+、NO3﹣、Cl﹣、H+
D. 无色溶液中:Na+、K+、ClO﹣、SO32﹣
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知298 K时,H+(aq)+OH-(aq)=H2O(l) ΔH=-57.3 kJ·mol-1,推测含1 mol HCl的稀溶液与含1 mol NH3的稀溶液反应放出的热量 ( )
A. 大于57.3 kJ B. 等于57.3 kJ
C. 小于57.3 kJ D. 无法确定
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列四组蛋白质中,可以在人体同一个细胞中产生的是( )
A. 胰高血糖素和胰蛋白酶 B. 抗体和干扰素
C. 溶菌酶和甲状腺激素受体 D. 生长激素和抗利尿激素
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】pH=0的某溶液中还可能存在Al3+、Fe2+、NH4+、Ba2+、Cl-、CO32-、SO42-、NO3-中的若干种,现取适量溶液进行如下一系列实验:
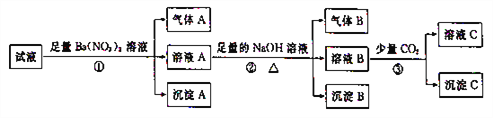
下列有关判断正确的是
A. 试液中一定有Fe2+、SO42-、H+、NH4+、A13+
B. 试液中一定没有Ba2+、CO32-、NO3-
C. 步骤③中一定发生反应:2AlO2-+CO2+3H2O=2Al(OH)3↓+CO32-
D. 气体A与气体B不可能发生化学反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D、E五种物质焰色反应均为黄色,它们按图所示关系相互转化.
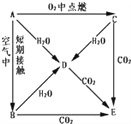
(1)这五种物质中,A: ___________、 C: ___________.
(2)将CO2通入E的饱和溶液中,该反应的离子方程式为______________________________.
(3)写出A→D、C→D、C→E反应的化学方程式
A→D:___________________________.
C→D:___________________________.
C→E:___________________________.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用块状碳酸钙与稀盐酸反应制取二氧化碳气体,下列可以降低反应速率的措施是
A. 加热 B. 加入浓盐酸
C. 加入蒸馏水 D. 将块状碳酸钙固体粉碎
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用水钴矿(主要成分为Co2O3,含少量Fe2O3、Al2O3、MnO、MgO、CaO等)制取草酸钴的工艺流程如下:

已知①浸出液含有的阳离子主要有H+、Co2+、Fe2+、Mn2+、Ca2+、Mg2+、Al3+等;
②部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:

(1)浸出过程中加入Na2SO3的目的是_____________。
(2)制取NaClO3可以将氯气通入到热的浓氢氧化钠溶液,该反应的离子方程式为__________________ ;实验需要制取10.65克NaClO3,需要的氯气由电解食盐水生成,若不考虑反应过程中的损失,则同时生成的氢气的体积为_______________ (标准状况)。
(3)萃取剂对金属离子的萃取率与pH的关系如图所示。

滤液Ⅱ中加入萃取剂的作用是_________;使用萃取剂适宜的pH是______(填选项序号)。
A.接近2.0 B.接近3.0 C.接近5.0
(4)“除钙、镁”是将溶液中Ca2+与Mg2+转化为MgF2、CaF2沉淀。
已知K sp(MgF2)=7.35×10-11、Ksp(CaF2)=1.05×10-10。当加入过量NaF后,所得滤液c(Mg2+)/ c(Ca2+)=________________。
(5)工业上用氨水吸收废气中的SO2。已知NH3·H2O的电离平衡常数K1 =1.8×10-5mol·L-1H2SO4的电离平衡常数K2=1.2×10-2mol·L-1,K3 =1.3×10-8mol·L-1。在通入废气的过程中:
当恰好形成正盐时,溶液中离子浓度的大小关系为____________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com