
X、Y、Z、M、Q、G六种短周期元素,原子序数依次增大。X、Z同主族,可形成离子化合物ZX;Y、M同主族,Y的一种同位素原子常用于测定文物的年代;Q形成的单质为淡黄色固体。请回答下列问题(涉及物质均用化学式表示)。
(1)离子化合物ZX中X离子的结构示意图为 ; Y在元素周期表中的位置是_______________。
(2)上述元素的最高价氧化物对应的水化物酸性最强的是_______________,Q与G的气态氢化物还原性更强的是__________________。
(3)工业上制备M的高纯度单质,其中一个重要反应是:由MXG3与X2在高温下反应。该反应过程必须控制无水无氧,因为MXG3遇水剧烈反应生成H2、 和 ,而混入氧气,引起的后果是 。
(4)X2Q的燃烧热为a kJ·mol-1,下列X2Q燃烧反应的热化学方程式正确的是 。
A.2X2Q(g) + O2(g) = 2Q(s) + 2X2O(g) △H= -2a kJ·mol-1
B.X2Q(g) + 2O2(g) = QO3(g) + X2O(l) △H= +a kJ·mol-1
C.2X2Q(g)+ 3O2(g) = 2QO2(g) + 2X2O(l) △H= -2a kJ·mol-1
D.X2Q(g) + 2O2(g) = QO3(g) + X2O(l) △H= -a kJ·mol-1
(5)熔融状态下,Z的单质和FeG2能组成可充电电池(装置示意图如下),反应原理为:2Z + FeG2  Fe
+ 2ZG 放电时,电池的正极反应式为: 该电池的电解质为___________________。
Fe
+ 2ZG 放电时,电池的正极反应式为: 该电池的电解质为___________________。
(16分)(1)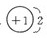 (2分) 第二周期IVA族(2分)
(2)HClO4(1分H2S(1分)
(2分) 第二周期IVA族(2分)
(2)HClO4(1分H2S(1分)
(3)H2SiO3(1分),HCl(1分),H2和O2混合发生爆炸或生成的Si部分被O2氧化成SiO2(1分)
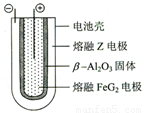
(4)C (3分) (5)Fe2+ +2e- = Fe (2分), β-Al2O3 (2分)
【解析】
试题分析:上述六种元素都是短周期元素,所以根据已知性质推:Q单质为淡黄色固体,则Q是S,在S之后的短周期主族元素是Cl,即G为Cl,用于同位素测定的为C,Y为C元素,与C同主族的M应该是Si,在C元素之前的X元素与同主族元素Z形成离子化合物ZX,则X、Z均在第一主族,且分别为H、Na,所以综上可得X、Y、Z、M、Q、G元素分别是H、C、Na、Si、S、Cl。
(1)X是H元素,所以在NaH中,H-的离子结构示意图为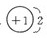 ,Y为C元素,其位置是:第二周期,第IVA族。
,Y为C元素,其位置是:第二周期,第IVA族。
(2)在这6种元素中非金属最强的是Cl,其最高价氧化对应的水化物HClO4酸性最强;Q、G的氢化物分别为H2S、HCl,因为非金属性Cl>S,单质的氧化性Cl2>S,所以离子的还原性Cl-<S2- ,所以还原性强的氢化物是H2S。
(3)MXG3与X2 分别为SiHCl3和H2,所以利用二者制备高纯硅时,若混入了水SiHCl3会与H2O发生剧烈水解反应,生成硅酸H2、H2SiO3和HCl;如果混入了氧气,则高温加热不纯H2会发生爆炸,或者O2又会氧化高温生成的单质硅,所以要控制无水无氧环境。
(4)X2Q是H2S,H2S燃烧是一个放热反应,所以△H<0,燃烧热a kJ·mol-1是指1mol该物质完全燃烧生成稳定氧化物SO2时所释放的能量,所以如果方程式系数是2时,对应的焓变△H= -2a kJ·mol-1 ,所以应该选择C。
(5)该电池反应式为:2Na+FeCl2 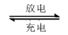 Fe+2NaCl,所以可知该反应中放电时单质Na作电池负极失去电子被氧化,Fe2+作正极得到电子被还原为Fe单质,所以正极反应式为:Fe2+ +
2e- =Fe;由于电池反应式在熔融状态下进行的,所以从图像可以判断出该电池的电解质溶液是β-Al2O3。
Fe+2NaCl,所以可知该反应中放电时单质Na作电池负极失去电子被氧化,Fe2+作正极得到电子被还原为Fe单质,所以正极反应式为:Fe2+ +
2e- =Fe;由于电池反应式在熔融状态下进行的,所以从图像可以判断出该电池的电解质溶液是β-Al2O3。
考点:本题考查的是元素周期表和元素周期律、非金属及其化合物性质、化学反应与能量、电化学基础等知识。


 各地期末复习特训卷系列答案
各地期末复习特训卷系列答案 小博士期末闯关100分系列答案
小博士期末闯关100分系列答案科目:高中化学 来源: 题型:


查看答案和解析>>
科目:高中化学 来源:2011-2012学年浙江省嵊泗中学高一上学期第一次月考化学试卷(带解析) 题型:填空题
(12分)元素X、Y、Z、M、Q均为短周期主族元素,且原子序数依次增大。已知元素Y最高价氧化物对应水化物与它的氢化物反应能生成一种盐;Z原子最外层电子数与核外电子总数之比为3:4;M可与Z形成阴、阳离子个数比为1:2的两种化合物,Q原子的最外层电子数与次外电子数之比为3:4,YX3常温下为气体。
(1)化合物A、B由X、Z、M、Q四种元素中的三种组成的强电解质,且A属于碱,B属于盐,组成元素的原子数目之比均为1:1:1,则化合物A的化学式为 ,B的化学式是 。
(2)Se是人体必备的微量元素,与Q同一主族。该族二至五周期元素单质分别与H2反应生成1mol 气态氢化物的反应热如下,表示生成1 mol哂化氢反应热(△H)的是 (填字母代号)。
A.+99.7kJ·mol-1 B.+29.7 kJ·mol-1
C.-20.6 kJ·mol-1 D.-241.8 kJ·mol-1
(3)X与Z、X与Q均可形成18电子分子甲和乙,写出甲、乙两种分子在水溶液中反
应生成Q单质的化学方程式 。X和Y也可形成18电子分子丙,它通常是一种液态火箭燃料。25℃、常压下,3.2g丙在氧气中完全燃烧放出热量为62.4kJ,请写出丙完全燃烧的热化学反应方程式 。
(4)X、Y两种元素形成的离子化合物的电子式为 。
查看答案和解析>>
科目:高中化学 来源:2013-2014学年天津市五区县高三上学期期末考试化学试卷(解析版) 题型:填空题
X、Y、Z、M、Q是五种短周期主族元素,原子序数依次增大。 X、Y可形成最常用溶剂;X、Y、Z最夕层电子数之和为8;Y、M形成的气态化合物在标准状况下的密度为2.86g 。请回答下列问题:
。请回答下列问题:
(1)Y、Z、M三种元素原子半径由小到大的顺序为(写元素符号)________________。
(2)Q在周期表中的位置是____________。
(3)X、Y、Q三种元素’形成的三原子分子结构式为______________;M、Q元素形成的最高价氧化物对应的水化物中较强的酸是(写化学式)_____________。
(4)Y与Z形成的化合物A既含离子键又含共价键,A的电子式为______________________;
将A加入盛有酚酞试液的试管中观察到的现象为_________________________________,发生反应的化学方程式为_________________。
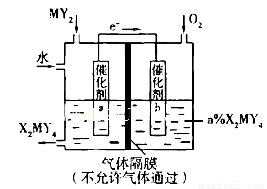
(5)利用下列装置可将化合物MY2转化为重要化工原料H2MY4。电极a的催化剂表面发生的电极反应方程式为__________________________________;理论上通人MY2与O2的物质的量最佳比值为________________。
查看答案和解析>>
科目:高中化学 来源:2014届浙江省高一上学期第一次月考化学试卷(解析版) 题型:填空题
(12分)元素X、Y、Z、M、Q均为短周期主族元素,且原子序数依次增大。已知元素Y最高价氧化物对应水化物与它的氢化物反应能生成一种盐;Z原子最外层电子数与核外电子总数之比为3:4;M可与Z形成阴、阳离子个数比为1:2的两种化合物,Q原子的最外层电子数与次外电子数之比为3:4,YX3常温下为气体。
(1)化合物A、B由X、Z、M、Q四种元素中的三种组成的强电解质,且A属于碱,B属于盐,组成元素的原子数目之比均为1:1:1,则化合物A的化学式为 ,B的化学式是 。
(2)Se是人体必备的微量元素,与Q同一主族。该族二至五周期元素单质分别与H2反应生成1mol 气态氢化物的反应热如下,表示生成1 mol哂化氢反应热(△H)的是 (填字母代号)。
A.+99.7kJ·mol-1 B.+29.7 kJ·mol-1
C.-20.6 kJ·mol-1 D.-241.8 kJ·mol-1
(3)X与Z、X与Q均可形成18电子分子甲和乙,写出甲、乙两种分子在水溶液中反
应生成Q单质的化学方程式 。X和Y也可形成18电子分子丙,它通常是一种液态火箭燃料。25℃、常压下,3.2g丙在氧气中完全燃烧放出热量为62.4kJ,请写出丙完全燃烧的热化学反应方程式 。
(4)X、Y两种元素形成的离子化合物的电子式为 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com