
| A. | 通常状况下14gN2中含有电子的数目为7NA | |
| B. | 标准状况下,22.4L水中含有水分子的数目为NA | |
| C. | 1molFe与足量稀盐酸反应时,转移电子的数目为3NA | |
| D. | 数目为NA的一氧化碳分子和0.5mol甲烷的质量比为7:4 |
分析 A、求出氮气的物质的量,然后根据1mol氮气含14mol电子来计算;
B、标况下,水为液态;
C、铁与盐酸反应后变为+2价;
D、根据m=$\frac{N}{{N}_{A}}M$求出CO的质量,根据m=nM求出甲烷的质量,然后计算.
解答 解:A、14g氮气的物质的量为0.5mol,而1mol氮气含14mol电子,故0.5mol氮气含7mol电子,故A正确;
B、标况下,水为液态,故不能根据气体摩尔体积来计算水的物质的量,故B错误;
C、铁与盐酸反应后变为+2价,故1mol铁转移2mol电子,故C错误;
D、NA个CO气体分子的质量m=$\frac{N}{{N}_{A}}M$=28g,0.5mol甲烷的质量m=nM=8g,故两者的质量之比为28:8=7:2,故D错误.
故选A.
点评 本题考查了阿伏伽德罗常数的有关计算,熟练掌握公式的使用和物质的结构是解题关键,难度不大.


 挑战100单元检测试卷系列答案
挑战100单元检测试卷系列答案科目:高中化学 来源: 题型:选择题
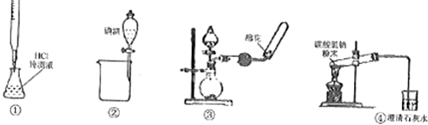
| A. | 利用装置①进行盐酸待测溶液浓度的测定 | |
| B. | 利用装置②分离碘酒中碘和酒精 | |
| C. | 利用装置③制备收集干燥氨气 | |
| D. | 利用装置④加热分解碳酸氢钠 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氯化铁溶液、溴水 | B. | 碳酸钠溶液、溴水 | ||
| C. | KMnO4酸性溶液、溴水 | D. | KMnO4酸性溶液、氯化铁溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | c(H+)=1×10-14mol/L的溶液:K+、Na+、AlO2-、S2O32- | |
| B. | 溶液中含大量Al3+:HClO、HCO3-、ClO-、CO32- | |
| C. | 能与Al反应生成H2的溶液:NH4+、Ca2+、NO3-、I- | |
| D. | 中性的溶液中:CO32-、Na+、SO42-、AlO2- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
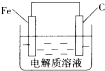 铁单质及其化合物在生活、生产中有广泛应用.请回答下列问题:
铁单质及其化合物在生活、生产中有广泛应用.请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
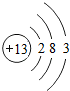 ,Al(OH)3的碱性比Mg(OH)2弱(填“强”或“弱”).
,Al(OH)3的碱性比Mg(OH)2弱(填“强”或“弱”). .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
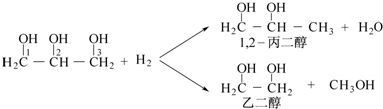
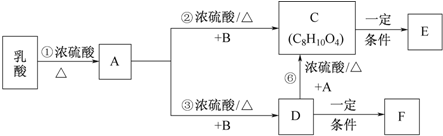
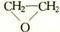 .
. .
.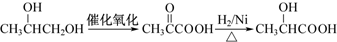 .
. .
.查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 碳酸钠常用于治疗胃溃疡病人的胃酸过多症 | |
| B. | 切开的金属Na暴露在空气中,光亮表面会逐渐变暗 | |
| C. | 发酵粉中主要含有碳酸氢钠,能使焙制出的糕点疏松多孔 | |
| D. | 金属钠着火时,可以使用泡沫灭火器来灭火 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 实验操作 | 实验目的 | |
| A | 制乙炔时用饱和食盐水代替水 | 加快化学反应速率 |
| B | CH4与SO2混合气体通过盛有溴水的洗气瓶 | 除去中CH4的SO2 |
| C | 淀粉溶液水解后冷却至室温,加新制氢氧化铜悬浊液观察现象 | 检验淀粉是否水解 |
| D | 将浓硫酸、乙醇混合加入试管中,加热,然后将导管末端插入酸性KMnO4溶液中,观察现象; | 检验是否有乙烯生成 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com