
| A. | 4FeS2( s)+11O2( g)═2Fe2O3( s)+8SO2(g)△H=-3414.8kJ•moL | |
| B. | FeS2(s)+$\frac{11}{4}$O2(g)═$\frac{1}{2}$Fe2O3 (s)+2SO2(g)△H=-853.7kJ•moL | |
| C. | 4FeS2(s)+11O2(g)═2 Fe2O3 (s)+8SO2(g)△H+3414.8kJ•moL | |
| D. | FeS2(s)+$\frac{11}{4}$O2(g)═$\frac{1}{2}$Fe2O3 (s)+2SO2(g)△H=+853.7kJ•moL |
分析 101kPa时燃烧1t含FeS2质量分数为70%的黄铁矿生成固态Fe2O3和气态SO2,放出4.98×106 kJ的热量,则燃烧120g即1molFeS2会放出热量为:$\frac{120×4.98×1{0}^{6}}{1{0}^{6}×70%}$kJ=853.7kJ,即FeS2(s)+$\frac{11}{4}$O2(g)═$\frac{1}{2}$Fe2O3(s)+2SO2(g);△H=-853.7kJ•mol-1,据此进行解答.
解答 解:101kPa时燃烧1t含FeS2质量分数为70%的黄铁矿生成固态Fe2O3和气态SO2,放出4.98×106 kJ的热量,则燃烧120g即1molFeS2会放出热量为:$\frac{120×4.98×1{0}^{6}}{1{0}^{6}×70%}$kJ=853.7kJ,即FeS2(s)+$\frac{11}{4}$O2(g)═$\frac{1}{2}$Fe2O3(s)+2SO2(g);△H=-853.7kJ•mol-1,
A.4molFeS2(s)完全反应放出热量为853.7kJ×4=3414.8kJ,则反应的热化学方程式为:4FeS2(s)+11O2(g)═2Fe2O3(s)+8SO2(g);△H=-3414.8kJ•mol-1,故A正确;
B.根据分析可知,反应的热化学方程式为:FeS2(s)+$\frac{11}{4}$O2(g)═$\frac{1}{2}$Fe2O3(s)+2SO2(g);△H=-853.7kJ•mol-1,故B正确;
C.该反应为放热反应,焓变值应该小于0,故C错误;
D.该反应为放热反应,焓变△H<0,故D错误;
故选AB.
点评 本题主要考查了热化学方程式的书写,题目难度不大,需要注意热化学方程式中物质的状态、反应热的数值与单位,反应热的数值与化学方程式前面的系数成正比.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:多选题
| A. | Fe | B. | Mg | C. | Al | D. | Zn |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1mol任何物质都含有6.02×1021个原子, | |
| B. | 0.012kg12C含有6.02×1023碳原子 | |
| C. | 阿伏伽德罗常数表示的粒子“集体”就是1mol | |
| D. | 使用摩尔这一单位时必须指明粒子的名称 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
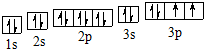 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
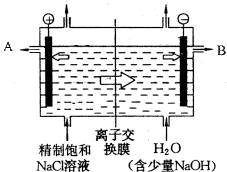 工业上电解制烧碱的技术是用离子交换膜法,主要原料是饱和食盐水.图为离子交换膜法电解原理示意图:
工业上电解制烧碱的技术是用离子交换膜法,主要原料是饱和食盐水.图为离子交换膜法电解原理示意图:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 某固体酸燃料电池以CsHSO4固体为电解质传递H+,其基本结构见如图,电池总反应可表示为:2H2+O2═2H2O,下列有关说法正确的是( )
某固体酸燃料电池以CsHSO4固体为电解质传递H+,其基本结构见如图,电池总反应可表示为:2H2+O2═2H2O,下列有关说法正确的是( )| A. | 电子通过外电路从b极流向a极 | |
| B. | b极上的电极反应式为:O2+4H++4e-═2H2O | |
| C. | 每转移0.1mol电子,消耗1.12L的H2 | |
| D. | H+由b极通过固体酸电解质传递到a极 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | C(Na+)>C(Ac-)=C(OH-)>C(H+) | B. | C(Na+)>C(Ac-)>C(OH-)>C(H+) | ||
| C. | C(Na+)=C(Ac-)+C(HAc) | D. | C(Na+)+C(H+)=C(Ac-)+C(OH) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com