
| A. | H2 和D2 互为同位素 | |
| B. | 40Ca和40K中质子数和中子数都不相等 | |
| C. | 只含一种元素的物质一定是纯净物 | |
| D. | 18O中中子数和质子数相等 |
分析 A、质子数相同中子数不同的原子互称同位素,互为同位素原子具有以下特征:质子数相同、中子数不同,研究对象为原子;
B、根据质子数+中子数=质量数来分析;
C、氧气与臭氧的混合物中只含有一种元素;
D、中子数=质量数-质子数,据此解答即可.
解答 解:A、H2和D2均是H元素形成得到单质,属于同种物质,不是同位素,故A错误;
B、40K的质子数为19,中子数为40-19=21,40Ca的质子数与中子数都是20,故B正确;
C、某物质只含一种元素,该物质不一定是纯净物,如氧气与臭氧的混合物中只含有一种元素,故C错误;
D、O元素的质子数为8,中子数=18-8=10,故两者不同,故D错误,
故选B.
点评 本题考查原子的构成、同位素、同素异形体、纯净物、混合物等,注重基础知识的考查,较简单.


 华东师大版一课一练系列答案
华东师大版一课一练系列答案 孟建平名校考卷系列答案
孟建平名校考卷系列答案科目:高中化学 来源: 题型:解答题

 ;
; .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 将块状固体药品研细后再反应 | |
| B. | 将H2O2溶液存放在低温冷暗处 | |
| C. | 用FeCl3溶液作H2O2分解反应的催化剂 | |
| D. | 用2 mol/L H2SO4溶液代替1 mol/L H2SO4溶液与锌粒反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NH4+、Ag+、CO32-、Cl- | B. | Fe3+、H+、I-、HCO3- | ||
| C. | K+、Na+、NO3-、Cl- | D. | H+、Fe2+、SO42-、NO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
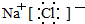 .
. 查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①③⑤ | B. | ②⑥ | C. | ④⑤ | D. | ①⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 金属晶体的熔点和沸点都很高 | |
| B. | CH4、CCl4都是含有极性键的非极性分子 | |
| C. | HF、HCl、HBr、HI的稳定性依次增强 | |
| D. | H2O是一种非常稳定的化合物,这是由于氢键所致 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 电极 | 电极材料 | 电极反应式 |
| 负极 | ||
| 正极 |
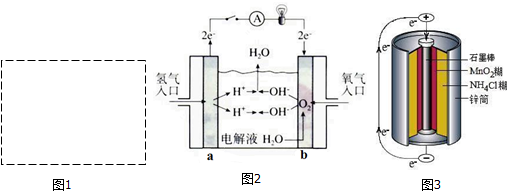
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com