
【题目】煤燃烧排放的烟气含有SO2和NOx,形成酸雨、污染大气,采用NaClO2溶液作为吸收剂可同时对烟气进行脱硫、脱硝。回答下列问题:
(1) NaClO2的化学名称为_______。
(2)在鼓泡反应器中通入含有SO2和NO的烟气,反应温度为323 K,NaClO2溶液浓度为5×103 mol·L1 。反应一段时间后溶液中离子浓度的分析结果如下表。
离子 | SO42 | SO32 | NO3 | NO2 | Cl |
c/(mol·L1) | 8.35×104 | 6.87×106 | 1.5×104 | 1.2×105 | 3.4×103 |
①写出NaClO2溶液脱硝过程中主要反应的离子方程式__________。增加压强,NO的转化率______(填“提高”、“不变”或“降低”)。
②随着吸收反应的进行,吸收剂溶液的pH逐渐______ (填“增大”“不变”或“减小”)。
③由实验结果可知,脱硫反应速率______脱硝反应速率(填“大于”或“小于”)。原因是除了SO2和NO在烟气中的初始浓度不同,还可能是___________。
(3)在不同温度下,NaClO2溶液脱硫、脱硝的反应中,SO2和NO的平衡分压pe如图所示。
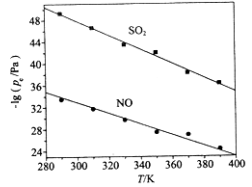
①由图分析可知,反应温度升高,脱硫、脱硝反应的平衡常数均______________(填“增大”、“不变”或“减小”)。
②反应ClO2+2SO32===2SO42+Cl的平衡常数K表达式为___________。
(4)如果采用NaClO、Ca(ClO)2替代NaClO2,也能得到较好的烟气脱硫效果。
①从化学平衡原理分析,Ca(ClO)2相比NaClO具有的优点是_______。
②已知下列反应:
SO2(g)+2OH (aq) ===SO32 (aq)+H2O(l) ΔH1
ClO (aq)+SO32 (aq) ===SO42 (aq)+Cl (aq) ΔH2
CaSO4(s) ===Ca2+(aq)+SO42(aq) ΔH3
则反应SO2(g)+ Ca2+(aq)+ ClO (aq) +2OH (aq) === CaSO4(s) +H2O(l) +Cl (aq)的ΔH=______。
【答案】(1)亚氯酸钠;(2)①4OH-+3ClO2-+4NO=4NO3-+3Cl-+2H2O;提高 ②减小;
③大于;NO溶解度较低或脱硝反应活化能较高 (3)①减小;②![]()
(4)①形成CaSO4沉淀,反应平衡向产物方向移动,SO2转化率提高 ②△H1+△H2-△H3
【解析】(1) NaClO2的化学名称为亚氯酸钠;
(2)①亚氯酸钠具有氧化性,则NaClO2溶液脱硝过程中主要反应的离子方程式为4OH-+3ClO2-+4NO=4NO3-+3Cl-+2H2O;正反应是体积减小的,则增加压强,NO的转化率提高。
②根据反应方程式2H2O+ClO2-+2SO2=2SO42-+Cl-+4H+、2H2O+3ClO2-+4NO=4NO3-+3Cl-+4H+可知随着吸收反应的进行氢离子浓度增大,吸收剂溶液的pH逐渐降低。
③由实验结果可知,在相同时间内硫酸根离子的浓度增加的多,因此脱硫反应速率大于脱硝反应速率。原因是除了SO2和NO在烟气中的初始浓度不同,还可能是二氧化硫的还原性强,易被氧化。
(3)在不同温度下,NaClO2溶液脱硫、脱硝的反应中,SO2和NO的平衡分压pe如图所示。
①由图分析可知,反应温度升高,SO2和NO的平衡分压负对数减小,这说明反应向逆反应方向进行,因此脱硫、脱硝反应的平衡常数均减小。
②根据反应的方程式ClO2+2SO32===2SO42+Cl可知平衡常数K表达式为![]() 。
。
(4)如果采用NaClO、Ca(ClO)2替代NaClO2,也能得到较好的烟气脱硫效果。
①①形成CaSO4沉淀,反应平衡向产物方向移动,SO2转化率提高,所以Ca(ClO)2效果好。
②已知:a.SO2(g)+2OH (aq) ===SO32 (aq)+H2O(l) ΔH1
b.ClO (aq)+SO32 (aq) ===SO42 (aq)+Cl (aq) ΔH2
c.CaSO4(s) ===Ca2+(aq)+SO42(aq) ΔH3
则根据盖斯定律可知a+b-c即得到反应SO2(g)+ Ca2+(aq)+ ClO (aq) +2OH (aq) === CaSO4(s) +H2O(l) +Cl (aq)的ΔH=△H1+△H2-△H3。


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】某制糖厂以甘蔗为原料制糖,同时得到大量的甘蔗渣,对甘蔗渣进行综合利用不仅可以提高综合效益,而且还能防止环境污染,生产流程如下:

已知石油列解已成为生产H的重要方法,E的溶液能发生银镜反应,G是具有香味的液体,试填空。
(1)A的名称______;G的名称______。
(2)B的结构简式_______;H的结构简式____________。
(3)写出H发生加聚反应的方程式:_____________。
(4)D→E的化学方程式:_____________。
(5)E→F的化学方程式:_____________。
(6)F→G的化学方程式:_____________。
(7)写出G的同分异构体中与CH3COOH互为同系物的结构简式:____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】可逆反应在一定条件下达到化学平衡时,下列说法不正确的是
A. 正反应速率等于逆反应速率 B. 反应物和生成物浓度不再发生变化
C. 反应体系中混合物的组成保持不变 D. 正、逆反应速率都为零
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关物质的性质与用途具有对应关系的是( )
A.NH3极易溶于水,可用于工业制冷剂
B.HNO3具有酸性,可用于制备硝酸盐原料
C.NH4 NO3易溶于水,可用于制造高温材料
D.N2难溶于水,可用于合成氨原料
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】饮食是保证我们身体健康的基本需求,下列关于饮食的说法正确的是
A. 鸡蛋含有丰富的蛋白质,人类需要的蛋白质都可以由鸡蛋提供,多吃有益
B. 水果、蔬菜含有丰富的维生素,有人为了减肥,每天只吃水果蔬菜即可
C. 米饭含有大量的淀粉,成人每天食用量不能超过200g。
D. 要促进身体健康,各种食物必须合理搭配
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学习小组用如下图所示装置A、B分别探究金属锌与稀硫酸的反应,实验过程中A烧杯内的溶液温度升高,B烧杯的电流计指针发生偏转,请回答以下问题。
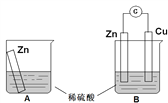
(1)A烧杯中反应的离子方程式为_________。
(2)B中Zn板是_________极,发生的电极反应是_________,Cu板上的现象是_________,发生的电极反应是_________。
(3)从能量转化的角度来看,A、B中反应物的总能量_________(填“大于”、“小于”或“等于”)生成物总能量,A中是将化学能转变为_________,B中主要是将化学能转变为_________。
(4)该小组同学反思原电池的原理,其中观点正确的是_________(填字母序号)。
A.原电池反应的过程中一定有电子转移
B.原电池装置需要2个电极
C.电极一定不能参加反应
D.氧化反应和还原反应可以拆开在两极发生
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验中能证明一种气体为SO2的是( )
①使澄清石灰水变浑浊 ②使湿润的蓝色石蕊试纸变红 ③使品红溶液褪色 ④通入足量的NaOH溶液中,再滴加BaCl2溶液,有白色沉淀生成,该沉淀溶于稀盐酸 ⑤通入溴水中使溴水褪色,再滴加Ba(NO3)2溶液有白色沉淀产生
A.都能证明 B.都不能证明
C.③④⑤能证明 D.只有⑤能证明
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于乙烯的叙述不正确的是( )
A.乙烯的化学性质比乙烷活泼
B.乙烯燃烧时火焰明亮,同时有少量黑烟
C.乙烯可作香蕉等水果的催熟剂
D.乙烯双键中的一个键可以断裂,容易发生加成反应和取代反应
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com