
| A. | 用HR做导电实验,灯泡很暗 | |
| B. | 0.1mol•L-1HR溶液稀释到100倍时,溶液的pH值为3 | |
| C. | 20mL0.1mol•L-1HR恰好中和20mL0.1mol•L-1NaOH溶液 | |
| D. | 0.1mol•L-1NH4R溶液的pH等于7 |
分析 酸的通性不能说明酸的电离程度,利用酸不能完全电离或盐类水解的规律来分析酸是弱电解质.
解答 解:A.溶液的导电性与离子的浓度有关,弱电解质的浓度大时导电实验中灯泡也很亮,没有对比实验,无法说明HR是弱电解质,故A错误;
B、将0.1mol•L-1HR溶液稀释到100倍,溶液的pH为3,则稀释后氢离子浓度变成0.001mol•L-1,则说明电离完全,所以HR为强电解质,故B错误;
C、20mL0.1mol•L-1HR恰好中和20mL0.1mol•L-1NaOH溶液,为酸碱中和反应,体现其酸性,但不能说明是弱酸,故C错误;
D、0.1mol•L-1NH4R溶液的pH等于7,说明铵根离子与R-离子都发生了水解并且相当,则说明是弱电解质,故D正确;
故选D.
点评 本题考查弱电解质的判断,明确弱电解质的性质是解答本题的关键,常用的方法是利用电离的不完全性、测定盐溶液的pH、做对比实验等来判断弱电解质.


科目:高中化学 来源: 题型:选择题
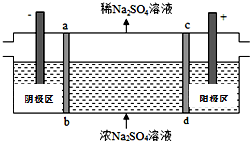 三室式电渗析法处理含Na2SO4废水的原理如图所示,采用惰性电极,ab、cd均为离子交换膜,在直流电场的作用下,两膜中间的Na+和SO42-可通过离子交换膜,而两端隔室中离子被阻挡不能进入中间隔室.下列叙述正确的是( )
三室式电渗析法处理含Na2SO4废水的原理如图所示,采用惰性电极,ab、cd均为离子交换膜,在直流电场的作用下,两膜中间的Na+和SO42-可通过离子交换膜,而两端隔室中离子被阻挡不能进入中间隔室.下列叙述正确的是( )| A. | 通电后中间隔室的SO42-离子向正极迁移,正极区溶液碱性增强 | |
| B. | 该法在处理含Na2SO4废水时可以得到NaOH和H2SO4产品 | |
| C. | 阴极区溶液pH降低,阳极区溶液pH升高 | |
| D. | 当电路中通过1mol电子的电量时,会有0.5mol的O2生成 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 实验必须使用温度计,且温度计的水银球应在蒸馏烧瓶的支管口处 | |
| B. | 冷凝管中的水流方向是从下口进入,上口排出 | |
| C. | 实验中需要在蒸馏烧瓶中加入几片碎瓷片,防止出现暴沸现象 | |
| D. | 用酒精灯加热时,蒸馏烧瓶必须垫石棉网 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
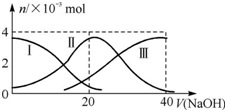 常温下,向20mL 0.2mol•L-1 H2A溶液中滴加0.2mol•L-1 NaOH溶液.有关微粒的物质的量变化如图所示.根据图示判断下列说法正确的是( )
常温下,向20mL 0.2mol•L-1 H2A溶液中滴加0.2mol•L-1 NaOH溶液.有关微粒的物质的量变化如图所示.根据图示判断下列说法正确的是( )| A. | 当V(NaOH)=20 mL时,溶液中离子浓度大小关系:c(Na+)>c(HA-)>c(A2-)>c(H+)>c(OH-) | |
| B. | 等浓度的NaOH溶液与H2A溶液按2:1混合后,其溶液中水的电离程度比纯水小 | |
| C. | NaHA溶液中:c(OH-)+c(A2-)=c(H+)+c(H2A) | |
| D. | 向上述加入20 mL NaOH溶液后所得溶液中再加入水的过程中,pH可能减小 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在$\frac{c({H}^{+})}{c(O{H}^{-})}$=1×1013的溶液中:NH4+、Ca2+、C1-、K+ | |
| B. | 澄清透明的无色溶液中:K+、Mg2+、NO3-、MnO4- | |
| C. | 使pH试纸呈红色的溶液中:I-、Cl-、NO3-、Na+ | |
| D. | 含有较多的Al3+的溶液中:K+、Ca2+、S2-、Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氧化性(酸性溶液):PbO2>Fe3+>S | |
| B. | 还原性(碱性溶液):Fe(OH)2>KCl>Cl2 | |
| C. | 酸性(水溶液):H2S>H2SO4>H2SeO4>HN3 | |
| D. | 热稳定性:CaCO3>FeCO3>Ag2CO3 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com