
【题目】A、B、C、D是中学常见的混合物分离或提纯的基本装置。

请根据混合物分离或提纯的原理,回答在下列实验中需要使用哪种装置。将A、B、C、D填入适当的空格中。
(1)除去Fe(OH)3胶体中悬浮的Fe(OH)3沉淀___;
(2)从碘水中提取碘___;
(3)用自来水制取蒸馏水___;
(4)除去粗盐中的泥沙___;
(5)与海水晒盐原理相符的是___。
【答案】B C A B D
【解析】
由装置图可知A为蒸馏,常用于分离沸点不同的液体混合物;B为过滤,常用于分离固液混合物;C为萃取分液;D为蒸发,结合混合物的性质的异同选择分离方法。
(1)除去Fe(OH)3胶体中悬浮的Fe(OH)3沉淀,可以选用过滤的方法,故答案为:B;
(2)碘在水中的溶解度较小,但易溶于有机物溶剂,可用萃取的方法分离,故答案为:C;
(3)用自来水制取蒸馏水,可用蒸馏的方法获得,故答案为:A;
(4)泥沙不溶于水,可用过滤的方法除去粗盐中的泥沙,故答案为:B;
(5)海水晒盐是利用水易挥发的性质,用太阳光提供能量使水变成水蒸气,实现盐和水的分离,相当于蒸发,故答案为:D。


 课时训练江苏人民出版社系列答案
课时训练江苏人民出版社系列答案科目:高中化学 来源: 题型:
【题目】磷是地壳中含量较为丰富的非金属元素,它的单质和化合物在工农业生产中应用广泛。白磷可通过反应 2Ca3(PO4)2+10C→6CaO+P4+10CO 获得。完成下列填空:
(1)磷原子的最外层电子排布式是__________,氧原子核外有______种不同运动状态的电子。C、O两种元素非金属性较强的是_______________。
(2)白磷在空气中露置时间长了会因温度达到____而自燃,使白磷升温的热量主要来自_________。某温度时,在2.0L恒容密闭容器中充入0.5mol PCl5,发生反应PCl5(g)![]() PCl3(g)+Cl2(g)-Q,经过一段时间后达到平衡。
PCl3(g)+Cl2(g)-Q,经过一段时间后达到平衡。
(3)该反应的平衡常数表达式 K=_____________;
(4)其他条件不变,起始时向上述容器中充入1.0 mol PCl5,达到平衡时,PCl5的转化率____(选填“增大”、 “减小”“不变”),平衡常数 K____(选填“增大”、 “减小”“不变”)。
(5)在不同时间(t)测得反应过程中 PCl5 的部分数据如下:
t(s) | 0 | 50 | 100 | 250 | 350 |
n(mol) | 0.5 | 0.42 | 0.41 | 0.40 | 0.40 |
则 100s 时, PCl3的物质的量浓度是__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】制取甲烷的反应为C(s)+2H2(g) ![]() CH4(g) △H > 0,欲提高反应的速率和H2的转化率,可采用的措施为 ( )
CH4(g) △H > 0,欲提高反应的速率和H2的转化率,可采用的措施为 ( )
A. 压缩容器体积B. 降温
C. 增大C(s)的量D. 恒温恒压时加入一定量H2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知短周期主族元素Q、T、U、V、W、X、Y、Z原子序数依次增大。已知:T与U、V同周期,W与X、Y、Z同周期,U和Y同族;元素Q的某种核素没有中子;元素T的最高正价与最低负价的代数和为0;Q与U形成的气态化合物相对分子质量为17;工业上通过分离液态空气获得V的单质,且该单质的某种同素异形体是保护地球地表环境的重要屏障;W、X、Z的最高价氧化物对应的水化物两两之间都能反应,且W、X、Z原子最外层电子数之和等于W的原子序数。
(1)Z元素原子的 L层电子数为______,元素 Y的原子结构示意图___________,T的一种核素在考古时常用来鉴定一些文物的年代,用的核素是___________(填核素符号)。
(2)元素Q与V可以形成18电子化合物的其电子式为_________,元素W与Q形成的化合物的类型_____________(填‘离子化合物’或‘共价化合物’)。
(3)V的氢化物比同主族其他元素的氢化物的熔沸点明显偏高,原因是___________。
(4)写出X、W 两种元素最高价氧化物对应的水化物相互反应的离子方程式:____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一种含铝、锂、钴的新型电子材料,生产中产生的废料数量可观,废料中的铝以金属铝箔的形式存在:钴以Co2O3·CoO的形式存在,吸附在铝箔的单面或双面;锂混杂于其中。从废料中回收氧化钴(CoO)工艺流程如下:
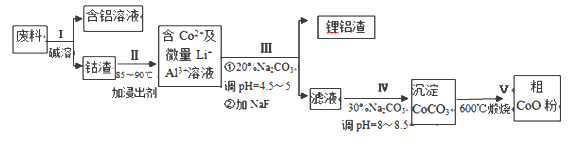
(1)过程Ⅰ中采用NaOH溶液溶出废料中的Al,反应的离子方程式为_________________。
(2)过程Ⅱ中加入稀H2SO4酸化后,再加入Na2S2O3溶液浸出钴。则浸出钴的化学反应方程式为 (产物中只有一种酸根)_________。在实验室模拟工业生产时,也可用盐酸浸出钴,但实际工业生产中不用盐酸,请从氧化还原和环境保护的角度分析不用盐酸浸出钴的主要原因____。
(3)过程Ⅲ得到锂铝渣的主要成分是LiF和Al(OH)3,碳酸钠溶液在产生Al(OH)3时起重要作用,请写出该反应的离子方程式_____ 。
(4)如图是CoCl2.6H2O晶体受热分解时,剩余固体的质量随温度变化的曲线,B物质的化学式是______________ 。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】纯净物X、Y、Z转化关系如图所示,下列判断正确的是( )

A. X可能是金属铜 B. Y不可能是氢气
C. Z可能是氯化钠 D. Z可能是三氧化硫
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】汽车尾气中CO、NOx以及燃煤废气中的SO2都是大气污染物,对它们的治理具有重要意义。
(1)氧化还原法消除NOx的转化如下所示:NO![]() NO2
NO2![]() N2
N2
①反应Ⅰ为NO+O3===NO2+O2,生成标准状况下11.2 L O2时,转移电子的物质的量是 __________mol。
②反应Ⅱ中,当n(NO2)∶n[CO(NH2)2]=3∶2时,氧化产物与还原产物的质量比为____。
(2)使用“催化转化器”可以减少尾气中的CO和NOx,转化过程中发生反应的化学方程式为CO+NOx→N2+CO2(未配平),若x=1.5,则方程式中CO2和N2的化学计量数之比为______。
(3)吸收SO2和NO,获得Na2S2O4和NH4NO3产品的流程图如图所示(Ce为铈元素)。
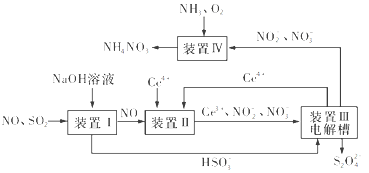
装置Ⅱ中,酸性条件下NO被Ce4+氧化的产物主要是NO3-和NO2-,请写出生成等物质的量的NO3-和NO2-时的离子方程式:________。
(4)已知进入装置Ⅳ的溶液中NO2-的浓度为a g·L-1,要使1 m3该溶液中的NO2-完全转化为NH4NO3,至少需向装置Ⅳ中通入标准状况下的氧气____L(用含a代数式表示,结果保留整数)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期元素X、Y、Z、W、Q在元素周期表中的相对位置如图1所示。下列说法正确的是

A. 元素X与元素Z的最高正化合价之和的数值等于8
B. 原子半径的大小顺序为:rX>rY>:rZ>rW>rQ
C. 离子Y2-和Z 3+的核外电子数和电子层数都不相同
D. 元素W的最高价氧化物对应的水化物的酸性比Q的强
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关电解质溶液的说法正确的是
A. 向0.1 mol·L-1 CH3COOH溶液中加入少量水,溶液中c(H+)/c(CH3COOH)减小
B. 将CH3COONa溶液从20 ℃升温至30 ℃,溶液中c(CH3COO-)/c(CH3COOH)c(OH-)增大
C. 向盐酸中加入氨水至中性,溶液中![]() >1
>1
D. 常温下,pH=2的醋酸溶液与pH=12的NaOH溶液等体积混合后,溶液pH<7
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com