
 .
. .
. 分析 (1)根据烷烃的通式CnH2n+2来计算;
(2)烷烃相对分子质量越大,沸点越高,同分异构体中,含支链越多,沸点越低;
(3)根据烷烃的组成通式CnH2n+2确定碳原子数目,书写该烷烃的分子式,根据主链减碳作为取代基进行书写戊烷的异构体;
(4)有机物完全燃烧生成二氧化碳和水的物质的量之比为2:3,根据C、H原子守恒知,该有机物中C、H原子个数之比=2:6;
(5)不饱和烃以及甲苯可被酸性高锰酸钾氧化.
解答 解:(1)烷烃的分子中含有14个氢原子,烷烃的通式为:CnH2n+2,则2n+2=14,所以n=6,即烷烃的分子式为C6H14,为己烷,故答案为:己烷;
(2)烷烃相对分子质量越大,沸点越高,同分异构体中,含支链越多,沸点越低,正丁烷,异丁烷,正戊烷三种物质,按沸点由高到低顺序排列为CH3-CH2-CH2-CH2-CH3>CH3CH2CH2CH3>(CH3)2CHCH3,
故答案为:CH3-CH2-CH2-CH2-CH3>CH3CH2CH2CH3>(CH3)2CHCH3,
(3)令该烷烃的分子式为CnH2n+2,相对分子质量为72,则14n+2=72,解得n=5,
故该烷烃的分子式为C5H12,C5H12的同分异构体有:CH3CH2CH2CH2CH3、CH3CH2CH(CH3)CH3、C(CH3)4,
故答案为:C5H12;CH3CH2CH2CH2CH3、CH3CH2CH(CH3)CH3、C(CH3)4;
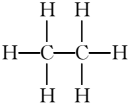
(4)有机物完全燃烧生成二氧化碳和水的物质的量之比为2:3,根据C、H原子守恒知,该有机物中C、H原子个数之比=2:6,应为乙烷,结构式为 ,
,
故答案为: ;
;
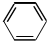
(5)丙烷为饱和烃,苯性质稳定,与高锰酸钾不反应,乙烯、丁烯含有碳碳双键,可被酸性高锰酸钾氧化,故答案为:CH3CH2CH3和 .
.
点评 本题综合考查有机物的结构和性质,为高频考点,侧重于学生的分析、计算能力的考查,注意把握有机物的分子式的确定方法以及有机物的性质,难度不大.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 150 mL 1 mol/L NaCl溶液 | B. | 75 mL 2 mol/L NH4Cl溶液 | ||
| C. | 75 mL 2 mol/L AlCl3溶液 | D. | 150 mL 1.5 mol/L MgCl2溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
 在2L密闭容器内,800℃时发生反应:2NO(g)+O2(g)═2NO2(g),在体系中,n(NO)随时间的变化如表:
在2L密闭容器内,800℃时发生反应:2NO(g)+O2(g)═2NO2(g),在体系中,n(NO)随时间的变化如表:| 时间(s) | 0 | 1 | 2 | 3 | 4 | 5 |
| NO的物质的量(mol) | 0.020 | 0.010 | 0.008 | 0.007 | 0.007 | 0.007 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com