
下列有关实验的说法正确的是( )
|
| A. | 中和滴定时,用待测溶液润洗锥形瓶 |
|
| B. | 使用pH试纸测定溶液pH时先润湿,则测得溶液的pH一定偏小 |
|
| C. | 用酸式滴定管量取12.00 mL高锰酸钾溶液 |
|
| D. | 在配制的硫酸亚铁溶液常加入一定量的铁粉和盐酸 |
| 化学实验方案的评价. | |
| 专题: | 实验评价题. |
| 分析: | A.锥形瓶不能润洗; B.如溶液呈中性,则pH不变; C.可用酸性滴定管量取高锰酸钾溶液,且可精确到0.01mL; D.不能引入杂质. |
| 解答: | 解:A.锥形瓶不能润洗,防止误差偏大,故A错误; B.pH不能事先湿润,湿润后如溶液呈中性,则pH不变,故B错误; C.可用酸性滴定管量取高锰酸钾溶液,且可精确到0.01mL,故C正确; D.不能引入杂质,应加入硫酸酸化,故D错误. 故选C. |
| 点评: | 本题考查较为综合,涉及滴定操作、pH试纸的使用、滴定以及除杂等操作,为高频考点,侧重于学生的实验能力和实验方法的考查,注意把握基本操作,难度不大. |


 小夫子全能检测系列答案
小夫子全能检测系列答案科目:高中化学 来源: 题型:
将5.6 g铁粉投入盛有100 mL 2 mol·L-1 稀硫酸的烧杯中,2 min 时铁粉刚好溶解完全。如果反应前后溶液的体积不变,则该反应的平均速率可表示为
A.v(Fe)=0.5 mol·L-1·min-1 B.v(H2SO4)=1 mol·L-1·min-1
C.v(H2)=1 mol·L-1·min-1 D.v(FeSO4)=0.5 mol·L-1·min-1
查看答案和解析>>
科目:高中化学 来源: 题型:
某容器中发生一个化学反应,反应过程中存在H2O、ClO-、CN-、HCO3-、N2、Cl-六种物质.在反应过程中测得ClO-和N2的物质的量随时间变化的曲线如图所示。下列有关判断中正确的是( )

A.还原剂是含CN-的物质,氧化产物不只有N2
B.氧化剂是ClO-,还原产物是HCO3-
C.配平后氧化剂与还原剂的化学计量数之比为5:2
D.若生成2.24LN2则转移电子1mol
查看答案和解析>>
科目:高中化学 来源: 题型:
盐酸、醋酸和碳酸氢钠是生活中常见的物质。下列表述正确的是( )
A.在NaHCO3溶液中加入与其等物质的量的NaOH,溶液中的阴离子只有CO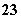 和OH-
和OH-
B.NaHCO3溶液中:[H+]+[H2CO3]=[OH-]
C.10 mL 0.10 mol·L-1 CH3COOH溶液加入等物质的量的NaOH后,溶液中离子的浓度由大到小的顺序是:[Na+]>[CH3COO-]>[OH-]>[H+]
D.中和体积与pH都相同的HCl溶液和CH3COOH溶液所消耗的NaOH物质的量相同
查看答案和解析>>
科目:高中化学 来源: 题型:
我国某大城市今年夏季多次降下酸雨.据环保部门测定,该城市整个夏季酸雨的pH平均为3.2.在这种环境中的铁制品极易被腐蚀.对此条件下铁的腐蚀的叙述不正确的是( )
|
| A. | 此腐蚀过程有化学腐蚀也有电化学腐蚀 |
|
| B. | 发生电化学腐蚀时的正极反应为 2H2O+O2+4e﹣═4OH﹣ |
|
| C. | 在化学腐蚀过程中有氢气产生 |
|
| D. | 发生电化学腐蚀时的负极反应为Fe﹣2e﹣═Fe2+ |
查看答案和解析>>
科目:高中化学 来源: 题型:
某温度下,在体积不变的容器中进行反应:CO(g)+2H2(g)⇌CH3OH(g)△H1=﹣90.7kJ•mol﹣1.已知反应的起始浓度分别为:c(CO)=1mol/L,c(H2)=2.4mol/L;5min后反应达平衡,此时CO的转化率为50%.则下列说法正确的是( )
|
| A. | 该反应属于熵增放热反应,一定能自发进行 |
|
| B. | 5 min内H2的平均反应速率为0.1 mol/(L•min) |
|
| C. | 其它条件不变的情况下,加入催化剂可提高CO的转化率 |
|
| D. | 若该温度下,反应物的起始浓度c(CO)=4 mol/L,c(H2)=a mol/L,达到平衡后,c(CH3OH)=2 mol/L,则a=5.4 |
查看答案和解析>>
科目:高中化学 来源: 题型:
下列各组离子在给定条件下能大量共存的是( )
A.在pH=1的溶液中:NH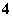 、K+、ClO-、Cl-
、K+、ClO-、Cl-
B.有SO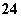 存在的溶液中:Na+、Mg2+、Ca2+、I-
存在的溶液中:Na+、Mg2+、Ca2+、I-
C.有NO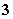 存在的强酸性溶液中:NH
存在的强酸性溶液中:NH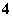 、Ba2+、Fe2+、Br-
、Ba2+、Fe2+、Br-
D.在[H+]=1.0×10-13 mol·L-1的溶液中:Na+、S2-、[Al(OH)4]-、SO
查看答案和解析>>
科目:高中化学 来源: 题型:
将0.2 mol·L-1 HA溶液与0.2 mol·L-1 NaOH溶液等体积混合,测得混合溶液中[Na+]>[A-],则(用“>”、“<”或“=”填写下列空白):
(1)混合溶液中[HA]________[A-];
(2)混合溶液中[HA]+[A-]________0.1 mol·L-1;
(3)混合溶液中由水电离出的[OH-]______0.2 mol·L-1 HA溶液中由水电离出的[H+];
(4)25℃时,如果取0.2 mol·L-1 HA溶液与0.1 mol·L-1 NaOH溶液等体积混合,测得混合溶液的pH<7,则HA的电离程度________NaA的水解程度。
查看答案和解析>>
科目:高中化学 来源: 题型:
在溶液中,反应A+2BC分别在三种不同实验条件下进行,它们的起始浓度均为c(A)=0.100 mol/L、c(B)=0.200 mol/L及c(C)=0 mol/L。反应物A的浓度随时间的变化如下图所示。

请回答下列问题:
(1)与①比较,②和③分别仅改变一种反应条件。所改变的条件和判断的理由是:
②________________________________________________________________________。
③________________________________________________________________________。
(2)实验②平衡时B的转化率为________;实验③平衡时C的浓度为________;
(3)该反应的ΔH________0。其判断理由是________________________________________________________________________________________________________________________________________________
(4)该反应进行到4.0 min 时的平均反应速率:
实验②:vB=___________________;
实验③:vC=___________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com