
| A. | a>b | B. | a=b | C. | a<b | D. | 无法确定 |
分析 固态S具有的能量大于气态S,则等量的S单质的燃烧时,气态硫放出的热量大于固体硫;放出的热量越大,a或b的数值越大,据此进行解答.
解答 解:已知反应①S(s)+O2(g)═SO2(g);△H=-a kJ•mol-1(a>0)、②S(g)+O2(g)═SO2(g);△H=-b kJ•mol-1(b>0),
反应①中S为固态,②中硫为气态,气态S具有能量大于固态S,则反应①放出热量大于反应②,
由于a、b为正值,则a<b,
故选C.
点评 本题考查了反应热大小比较,题目难度不大,明确物质状态与具有能量的关系为解答关键,注意题干中焓变为-a、-b,为易错点,试题培养了学生的分析能力及灵活应用能力.


科目:高中化学 来源: 题型:选择题
| A. | 2Na+2H2O═2NaOH+H2↑ | B. | 3NO2+H2O═2HNO3+NO | ||
| C. | 2F2+2H2O═4HF+O2 | D. | SO2+H2O═H2SO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
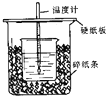 (1)在如图所示的装置中,50mL0.50mol•L-1盐酸与50mL0.55mol•L-1NaOH溶液进行中和反应,通过测定该反应过程中所放出的热量可计算中和热.回答下列问题:
(1)在如图所示的装置中,50mL0.50mol•L-1盐酸与50mL0.55mol•L-1NaOH溶液进行中和反应,通过测定该反应过程中所放出的热量可计算中和热.回答下列问题:| 实验序号 | A | B | C |
| 加入试剂 | KMnO4、H2C2O4 | KMnO4、H2C2O4 1gMnSO4粉末 | KMnO4、H2C2O4 1gNa2SO4粉末 |
| 完全褪色时间/s | 116 | 6 | 117 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
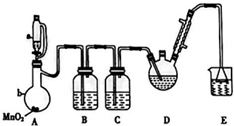 三氧乙醛(CCl3CHO)是生产农药、医药的重要中间体.实验室制备三氧乙醛的反应装置示意图(加热装置未画出)和有关数据如下:
三氧乙醛(CCl3CHO)是生产农药、医药的重要中间体.实验室制备三氧乙醛的反应装置示意图(加热装置未画出)和有关数据如下:| 物质 | C2H5OH | CCl3CHO | CCl3COOH | C6H5Cl |
| 熔点/℃ | -114.1 | -57.5 | 58 | -138.7 |
| 沸点/℃ | 78.3 | 97.8 | 198 | 12.3 |
| 溶解性 | 与水互溶 | 可溶于水、乙醇 | 可溶于水、乙醇 | 微溶于水,可溶于乙醇 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,22.4LCH4和CH3CH2OH的混合物所含分子数为NA | |
| B. | 常温常压下,16g14CH4所含中子数数目为8NA | |
| C. | 15.6gNa2O2和水完全反应转移的电子数为0.2NA | |
| D. | 0.1L3mol/L的NH4NO3溶液中含有的NH4+数目为0.3NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1 mol H2与0.5 molO2反应放出的热就是H2的燃烧热 | |
| B. | 1 mol H2SO4与1 molBa(OH)2反应时放出的热叫做中和热 | |
| C. | 热化学方程式中的化学计量数表示物质的量,可以是分数 | |
| D. | △H>0表示放热反应,△H<0 表示吸热反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
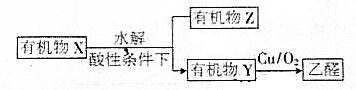
| A. | X可能是淀粉或纤维素 | B. | Y与CH3OCH3互为同分异构体 | ||
| C. | Z可能含有多个羧基 | D. | X中含有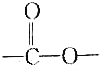 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题

| A. | B烧杯中加一定量的KCl固体可使溶液恢复原状 | |
| B. | c电极周围溶液变红 | |
| C. | A烧杯内Cu2+浓度降低 | |
| D. | d电极上可以析出使湿润的淀粉KI试纸变蓝的气体 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com