
 溴乙烷是一种重要的有机化工原料,其沸点为38.4℃.制备溴乙烷的一种方法是乙醇与氢溴酸反应.某课外小组欲在实验室制备溴乙烷的装置如右图,实验操怍步骤如下:
溴乙烷是一种重要的有机化工原料,其沸点为38.4℃.制备溴乙烷的一种方法是乙醇与氢溴酸反应.某课外小组欲在实验室制备溴乙烷的装置如右图,实验操怍步骤如下:分析 (1)长玻璃导管的作用是冷凝回流;
(2)浓硫酸具有氧化性,可以将还原性的溴离子氧化为溴单质;
(3)溴单质溶解在有机物中显示棕黄色,溴单质可以和氢氧化钠发生反应;实现互不相溶液体的分离采用分液漏斗来分液;
(4)互相溶解的物质的分离采用蒸馏法;
(5)检验溴乙烷中含有溴元素一定要将之转化为溴离子,根据溴离子可以和银离子反应生成淡黄色不溶于硝酸的沉淀来检验.
解答 解:(1)实验时,长玻璃导管的作用是冷凝回流,可以获得要制取的有机物,
故答案为:冷凝回流;
(2)溴单质溶解在有机物中显示棕黄色,为了除去粗产品中的杂质溴单质,可以用氢氧化钠来与之发生反应生成的溶液和溴乙烷互不相溶;
实现溴乙烷和氯化钠、次氯酸钠水溶液的分离可以采用分液法,用分液漏斗来分液,
故答案为:a;分液漏斗;
(3)用蒸馏水洗涤,分液后,再加入无水CaCl2,溴乙烷的沸点较低,可以采用蒸馏来分离,
故答案为:b;
(4)为了检验溴乙烷中含有溴元素,不能直接向溴乙烷中滴加硝酸银溶液来检验,是因为溴乙烷为非电解质,溴乙烷不能与硝酸银溶液反应生成沉淀;检验溴乙烷中含有溴元素一定要将之转化为溴离子,可以采用卤代烃的水解方法,即加入氢氧化钠即可,在溴离子可以和银离子反应生成淡黄色不溶于硝酸的沉淀溴化银来检验,可以加入硝酸酸化的硝酸银,
故答案为:④①③②.
点评 本题考查了溴乙烷的制取方法,题目难度中等,明确制备原理及化学实验基本操作方法为解答关键,试题知识点较多、综合性较强,充分考查学生的分析能力及化学实验能力.


 全优点练单元计划系列答案
全优点练单元计划系列答案科目:高中化学 来源: 题型:选择题
| 容器 | 甲 | 乙 | 丙 |
| 反应物投入量 | 2mol CO、1mol O2 | 2mol CO2 | 4mol CO2 |
| CO2的浓度(mol•L-1) | C1 | C2 | C3 |
| 反应的能量变化 | 放出aKJ | 吸收bKJ | 吸收CkJ |
| 体系压强(Pa) | P1 | P2 | P3 |
| A. | 2c1<c3 | B. | a+b=283.0 | C. | 2p2>p3 | D. | c1=c2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题


查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| 物质 | 熔点/0C | 沸点/0C |
| 1-丁醇 | -89.5 | 117.3 |
| 1-溴丁烷 | -112.4 | 101.6 |
| 丁醚 | -95.3 | 142.4 |
| 1-丁烯 | -185.3 | -6.5 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
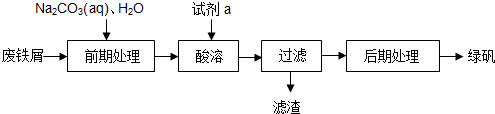
 用含少量铁的氧化物的氧化铜制取氯化铜晶体(CuCl2•xH2O).有如图操作:
用含少量铁的氧化物的氧化铜制取氯化铜晶体(CuCl2•xH2O).有如图操作:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.3 mol•L-1•s-1 | B. | 0.4 mol•L-1•s-1 | C. | 0.6 mol•L-1•s-1 | D. | 0.8 mol•L-1•s-1 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com