
![]() 时,A气体与B气体反应生成C气体.反应过程中A、B、C浓度变化如图(I)所示,若保持其他条件不变,温度分别为T1和T2时,B的体积分数与时间的关系如图(Ⅱ)所示,则下列结论正确的是( )
时,A气体与B气体反应生成C气体.反应过程中A、B、C浓度变化如图(I)所示,若保持其他条件不变,温度分别为T1和T2时,B的体积分数与时间的关系如图(Ⅱ)所示,则下列结论正确的是( )
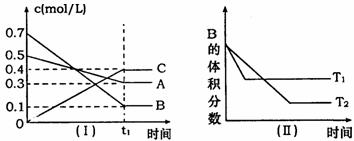
A.在(t1+10)min时,保持其他条件不变,增大压强,平衡向逆反应方向移动
B.其他条件不变,升高温度,正、逆反应速率均增大,且A的转化率增大
C.![]() 时,在相同容器中,若由0.4mol/L A、0.4mol/L B和0.2mol/L C反应,达到平衡后,C的浓度也为0.4 mol/L
时,在相同容器中,若由0.4mol/L A、0.4mol/L B和0.2mol/L C反应,达到平衡后,C的浓度也为0.4 mol/L
D.(t1+10)min时,保持压强不变,通入稀有气体,平衡不移动
科目:高中化学 来源: 题型:
| 时间/s c/mol?L-1 |
0 | 20 | 40 | 60 | 80 | 100 |
| N2O4 | 0.20 | a | 0.10 | c | d | e |
| NO2 | 0 | 0.12 | b | 0.26 | 0.30 | 0.30 |

查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
查看答案和解析>>
科目:高中化学 来源: 题型:
| △ |
查看答案和解析>>
科目:高中化学 来源: 题型:
 由短周期元素组成的10种物质A~J之间有下图关系.已知:A、B为同周期相邻元素的单质,其余均为化合物;通常情况下A为固体,B、D为气体且B呈黄绿色,F为液体,A和G的浓溶液加热时反应生成D和F,J在光照时有I生成.
由短周期元素组成的10种物质A~J之间有下图关系.已知:A、B为同周期相邻元素的单质,其余均为化合物;通常情况下A为固体,B、D为气体且B呈黄绿色,F为液体,A和G的浓溶液加热时反应生成D和F,J在光照时有I生成.

 MnCl2+Cl2↑+2H2O
MnCl2+Cl2↑+2H2O MnCl2+Cl2↑+2H2O
MnCl2+Cl2↑+2H2O| 实验步骤 | 实验现象 | 用化学用语解释 |
| 将少量气体通 入淀粉KI溶液 |
溶液最初变成 蓝 蓝 色 |
Cl2+2I-=2Cl-+I2 Cl2+2I-=2Cl-+I2 (用离子方程式表示) |
| 继续通入气体 | 溶液逐渐变成无色 | 5Cl2+I2+6H2O=10HCl+2HIO3 5Cl2+I2+6H2O=10HCl+2HIO3 (用化学方程式表示) |
查看答案和解析>>
科目:高中化学 来源:2013-2014学年高考化学二轮专题冲刺第8讲 电化学基础练习卷(解析版) 题型:填空题
金属冶炼与处理常涉及氧化还原反应。
(1)由下列物质冶炼相应金属时采用电解法的是________。
a.Fe2O3? ??? b.NaCl?????? c.Cu2S???? ? d.Al2O3
(2)辉铜矿(Cu2S)可发生反应:2Cu2S+2H2SO4+5O2=4CuSO4+2H2O,该反应的还原剂是________。当1 mol O2发生反应时,还原剂所失电子的物质的量为________mol。向CuSO4溶液中加入镁条时有气体生成,该气体是________。
(3)如图为电解精炼银的示意图,________(填“a”或“b”)极为含有杂质的粗银,若b极有少量红棕色气体产生,则生成该气体的电极反应式为__________________________。
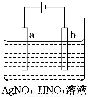
(4)为处理银器表面的黑斑(Ag2S),将银器浸于铝质容器里的食盐水中并与铝接触,Ag2S转化为Ag,食盐水的作用是______________________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com