
| A. | 18g H2O含有的氢原子数目为NA | |
| B. | 标准状况下,22.4L CO2含有的分子数目为NA | |
| C. | 1L1mol•L-1Na2SO4溶液中含有钠离子数目为NA | |
| D. | 1mol H2在Cl2中完全燃烧转移的电子数目为NA |
分析 A、求出水的物质的量,然后根据水中含2个氢原子来分析;
B、求出二氧化碳的物质的量,然后根据分子个数N=nNA来分析;
C、求出硫酸钠的物质的量n=CV,然后根据1mol硫酸钠中含2mol钠离子来分析;
D、氢气和氯气反应后变为+1价.
解答 解:A、18g水的物质的量为1mol,而水中含2个氢原子,故1mol水中含2mol氢原子即2NA个,故A错误;
B、标况下22.4L二氧化碳的物质的量为1mol,而分子个数N=nNA=1mol×NA/mol=NA个,故B正确;
C、溶液中硫酸钠的物质的量n=CV=1mol/L×1L=1mol,而1mol硫酸钠中含2mol钠离子,故1mol硫酸钠中含2mol钠离子即2NA个,故C错误;
D、氢气和氯气反应后变为+1价,故1mol氢气反应转移2NA个电子,故D错误.
故选B.
点评 本题考查了阿伏伽德罗常数的有关计算,掌握物质的量的计算公式和物质结构是解题关键,难度不大.


科目:高中化学 来源: 题型:解答题
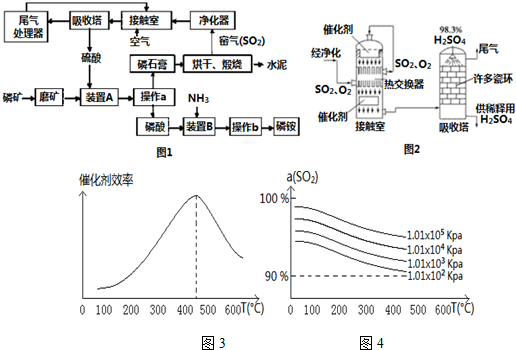
查看答案和解析>>
科目:高中化学 来源: 题型:实验题

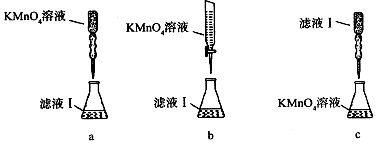
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 各组成元素质量分数相同的烃是同一种烃 | |
| B. | 结构相似,组成上相差一个或若干个CH2原子团的有机物是同系物 | |
| C. | 能使溴的四氯化碳溶液褪色的烃一定是烯烃 | |
| D. | C3H6和C4H8不一定是同系物 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 夜里的月色本身就很美 | |
| B. | 空气中的小水滴颗粒直径约为1nm-100nm | |
| C. | 光线是一种胶体 | |
| D. | 雾是一种胶体,能产生丁达尔现象 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
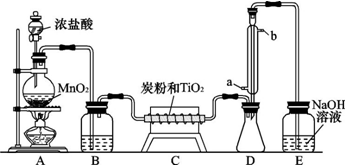
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com