

| 序号 | n(丙酸):n(碱式碳酸锌) | 反应 温度/℃ | 丙酸锌 产率/% |
| 1 | 1:0.25 | 60 | 67.2 |
| 2 | 1:0.25 | 80 | 83.5 |
| 3 | 1:0.25 | 100 | 81.4 |
| 4 | 1:0.31 | 60 | 89.2 |
| 5 | 1:0.31 | 80 | 90.1 |
| 6 | 1:0.31 | 100 | 88.8 |
分析 碱式碳酸锌为原料制丙酸锌,碱式碳酸锌与丙酸反应生成丙酸锌溶液,趁热过滤得丙酸锌溶液,将滤液蒸发浓缩、冷却结晶、过滤后干燥得丙酸锌晶体,趁热过滤的滤渣含有碱式碳酸锌,可以循环利用,过滤后的母液中含有丙酸锌,也可以循环利用,
(1)根据题给的反应物和生成物利用元素守恒书写化学方程式;
(2)在热溶液中,丙酸锌的溶解度较大,所以趁热过滤可以减小丙酸锌析出;
(3)丙酸易挥发,浓度过大,反应不易完全,且易造成丙酸挥发损失,不利于提高产率和产品的纯度;
(4)根据表中数据通过对比两组实验数据,选择产率最高的条件;
(5)根据(1)中的方程式可以计算出37.0g丙酸理论上可以产生丙酸锌的质量,再根据产率=$\frac{实际产量}{理论产量}$×100%计算;
(6)本工艺“采用闭路循环”方式,可以使原料利用率高,无废液、废渣排放;
解答 解:碱式碳酸锌为原料制丙酸锌,碱式碳酸锌与丙酸反应生成丙酸锌溶液,趁热过滤得丙酸锌溶液,将滤液蒸发浓缩、冷却结晶、过滤后干燥得丙酸锌晶体,趁热过滤的滤渣含有碱式碳酸锌,可以循环利用,过滤后的母液中含有丙酸锌,也可以循环利用,
(1)碱式碳酸锌与丙酸反应的化学方程式为4CH3CH2COOH+Zn2(OH)2CO3→2Zn(CH3CH2COO)2+CO2↑+3H2O,
故答案为:4CH3CH2COOH+Zn2(OH)2CO3→2Zn(CH3CH2COO)2+CO2↑+3H2O;
(2)在热溶液中,丙酸锌的溶解度较大,所以趁热过滤可以减小丙酸锌析出,所以采用趁热过滤的方式,其目的是防止醋酸锌结晶析出,
故答案为:防止醋酸锌结晶析出;
(3)丙酸易挥发,浓度过大,反应不易完全,且易造成丙酸挥发损失,不利于提高产率和产品的纯度,所以用水量不宜过少,
故答案为:水的用量较少时,反应不易完全,且易造成丙酸挥发损失,不利于提高产率和产品的纯度;
(4)根据表中数据,比较1、2、3或4、5、6可知,不同温度下以80℃丙酸锌的产率最高,比较2、5可知,相同温度下,n(丙酸):n(碱式碳酸锌)=1:0.31时,丙酸锌的产率高,所以选择的条件为1:0.31、80℃,
故答案为:0.31;80;
(5)根据4CH3CH2COOH+Zn2(OH)2CO3→2Zn(CH3CH2COO)2+CO2↑+3H2O方程式可知37.0g丙酸理论上可以产生丙酸锌的质量为$\frac{211}{74×2}×37.0g$=52.75g,所以产率=$\frac{实际产量}{理论产量}$×100%=$\frac{49.6g}{52.75g}$×100%=94.0%,
故答案为:94.0%;
(6)本工艺“采用闭路循环”方式,可以使原料利用率高,无废液、废渣排放,
故答案为:原料利用率高,无废液、废渣排放.
点评 本题考查制备实验方案的设计,涉及为高考不变的一个题型,每年高考必考,是热点题型、也是高考难点之一,本题主要考查了实验原理的分析、实验基本操作、实验条件的选择、产率的计算等,难度中等,侧重对学生的能力考查.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 铁与稀硫酸反应 Fe+2H+═Fe3++H2↑ | |
| B. | 氢氧化铝与足量盐酸反应 Al(OH)3+3H+═Al3++3H2O | |
| C. | 钠和冷水反应 Na+2H2O═Na++H2↑+OH- | |
| D. | 铜片与稀硝酸反应 Cu+NO3-+4H+═Cu2++NO↑+2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 阳离子 | Na+ Al3+Fe3+ Cu2+、Ba2+ |
| 阴离子 | OH- Cl- CO32- NO3- SO4- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 实验 | 温度/℃ | 起始时R的物质的量/mol | 平衡时气体总物质的量/mol |
| ① | 300 | 2.00 | 2.80 |
| ② | 400 | 2.00 | 3.00 |
| ③ | 400 | 4.00 | a |
| A. | 上述反应中,△H<0 | |
| B. | 实验②中,该反应的平衡常数K=0.5 | |
| C. | 实验①经4 min达到平衡,0~4 min内υ(X)=0.2mol•L-1•min-1 | |
| D. | 实验③中a=6.00 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 Ⅰ.在某温度时按n(N2):n(H2)=1:3的比例将混合气体投入密闭容器中反应:N2(g)+3H2(g)═2NH3(g)△H<0;
Ⅰ.在某温度时按n(N2):n(H2)=1:3的比例将混合气体投入密闭容器中反应:N2(g)+3H2(g)═2NH3(g)△H<0;查看答案和解析>>
科目:高中化学 来源: 题型:解答题
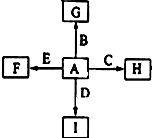 如图中,A、B、C、D、E是单质,G、H、I、F是B、C、D、E分别和A形成的二元化合物,已知:①反应C+G$\stackrel{高温}{→}$B+H能放出大量的热,G为红棕色;②I是一种常见的温室气体,它和E可以发生反应:2E+I$\frac{\underline{\;点燃\;}}{\;}$ 2F+D,F中的E元素的质量分数为60%.回答问题:
如图中,A、B、C、D、E是单质,G、H、I、F是B、C、D、E分别和A形成的二元化合物,已知:①反应C+G$\stackrel{高温}{→}$B+H能放出大量的热,G为红棕色;②I是一种常见的温室气体,它和E可以发生反应:2E+I$\frac{\underline{\;点燃\;}}{\;}$ 2F+D,F中的E元素的质量分数为60%.回答问题:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com