
| A.MnO2 | B.FeO | C.Cr2O3 | D.V2O5 |
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源:不详 题型:单选题
| A.铝质轻,便于运输,储存,且安全 |
| B.铝燃烧时放出的热量大,且燃烧后的产物对环境的污染容易得到有效控制 |
| C.在地球上,铝矿资源丰富 |
| D.现代工业是利用电解铝的方法制取铝,这为把铝作为新能源奠定基础 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
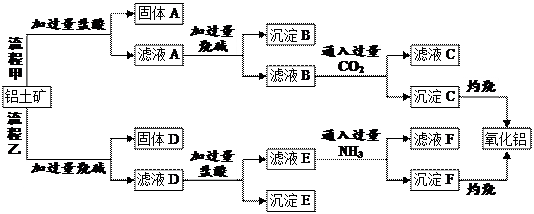
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
 金片上剪下一小块(质量为1.0g),立即投入到盛有10mL10mol/LNaOH溶液的小烧杯中。
金片上剪下一小块(质量为1.0g),立即投入到盛有10mL10mol/LNaOH溶液的小烧杯中。 极反应式:
极反应式: 查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
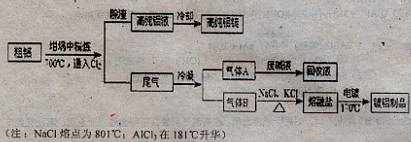
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
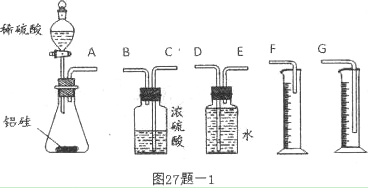
 _______________________________________________________________。
_______________________________________________________________。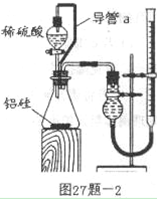
 ___________________________
___________________________查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.Zn、Al | B.Fe、Zn | C.Al、Mg | D.Mg、Cu |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.Al>Mg>Fe | B.Mg>Al>Fe |
| C.Fe>Al>Mg | D.Mg=Al=Fe |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com