
| A、△H3=△H1+2△H2 |
| B、△H3=△H1+△H2 |
| C、△H3=△H1-2△H2 |
| D、△H3=△H1-△H2 |


科目:高中化学 来源: 题型:
| A、262.6 kJ?mol-1 |
| B、-131.3 kJ?mol-1 |
| C、-352.3 kJ?mol-1 |
| D、131.3 kJ?mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
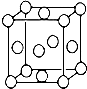 某配位化合物为深蓝色晶体,由原子序数依次增大的A、B、C、D、E五种元素组成,其原子个数比为l4:4:5:1:1. 其中C、D元素同主族且原子序数D为C的二倍,E元素的外围电子排布为(n-1)dn+6nsl,回答下列问题.
某配位化合物为深蓝色晶体,由原子序数依次增大的A、B、C、D、E五种元素组成,其原子个数比为l4:4:5:1:1. 其中C、D元素同主族且原子序数D为C的二倍,E元素的外围电子排布为(n-1)dn+6nsl,回答下列问题.查看答案和解析>>
科目:高中化学 来源: 题型:
| 1 |
| 2 |
| A、-283.01kJ?mol-1 |
| B、+172.51kJ?mol-1 |
| C、+283.1kJ?mol-1 |
| D、+504.00kJ?mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| 化学式 | Zn(OH)2 | ZnS | AgCl | Ag2S | MgCO3 | Mg(OH)2 |
| 溶度积 | 5×10-17 | 2.5×10-22 | 1.8×10-10 | 6.3×10-50 | 6.8×10-6 | 1.8×10-11 |
| A、2AgCl+Na2S═2NaCl+Ag2S | ||||
B、MgCO3+H2O
| ||||
| C、ZnS+2H2O═Zn(OH)2+H2S↑ | ||||
| D、Mg(HCO3)2+2Ca(OH)2═Mg(OH)2↓+2CaCO3↓+2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
 ,不符合
,不符合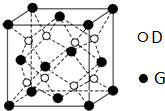
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com