
【题目】已知NA是阿伏加德罗常数的值,下列说法正确的是
A.72gCaO2中阴离子数目为2NA
B.将0.1molCl2通入1L水中,转移的电子数为0.1NA
C.标准状况下,11.2LO2和22.4LNO在密闭容器中充分混合后,气体分子总数小于NA
D.室温下1LpH=13的NaOH溶液中,水电离出的OH-的数目为0.1NA
【答案】C
【解析】
A.72gCaO2的物质的量为1mol,1mol过氧化钙中含1molO22-,故1mol过氧化钙中含NA个阴离子,A选项错误;
B.氯气与水反应为可逆反应,不能进行到底,所以将0.1molCl2通入水中,转移电子数小于0.1NA,B选项错误;
C.标准状况下,11.2LO2和22.4LNO的物质的量分别为0.5mol和1mol,两者混合后转化为NO2,但容器内存在反应2NO2![]() N2O4,则气体分子总数小于NA,C选项正确;
N2O4,则气体分子总数小于NA,C选项正确;
D.在pH=13的氢氧化钠溶液中,H+的物质的量浓度为10-13mol/L,全部来自于水的电离,而水电离出的氢氧根的浓度等于水电离出的氢离子的浓度,故pH=13的氢氧化钠中,水电离出的OH-的个数为10-13NA,D选项错误;
答案选C。


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】芳香化合物F是有机化工的重要原料,也可制毒,受公安部管制。
已知:苯环上有烷烃基时,新引入的取代基连在烷烃基的邻对位上;苯环上有羧基时,新引入的取代基连在羧基的间位上。
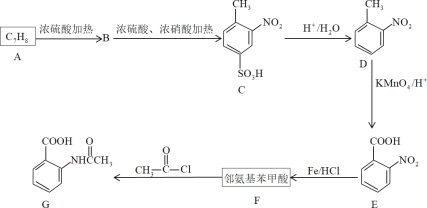
(1)D物质的名称为___,G中官能团的名称为___、___。
(2)A、F的结构简式分别为___、___,E生成F的反应类型是___。
(3)写出A→B产生较多的副产物的结构简式___,该流程未采用甲苯直接硝化的方法制取D,而是经历几步反应才制得D的目的是___。
(4)F在一定条件下能发生聚合反应,请写出其化学反应方程式___。
(5)F的同分异构体中,氨基直接连在苯环上、且能发生银镜反应的芳香族化合物共有___种(不含立体结构)。
(6)请以甲苯为原料,写出合成间氨基苯甲酸的流程图___(无机试剂任选)。合成流程图表示方法示例:CH2=CH2![]() CH3CH2Br
CH3CH2Br![]() CH3CH2OH
CH3CH2OH
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定温度下,可逆反应X(g)+3Y(g)![]() 2Z(g)达到化学平衡状态的标志是
2Z(g)达到化学平衡状态的标志是
A.Z的生成速率和X的分解速率相等
B.单位时间内生成nmolX,同时生成了3nmolY
C.X、Y、Z的浓度不再变化
D.X、Y、Z的分子个数之比为1∶3∶2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学实验室产生的废液中含有 Fe3+、Cu2+、Ag+三种金属离子,甲同学设计了如下图所示的方案对废液进行处理,以回收金属,保护环境。据此分析,下列说法正确的是( )
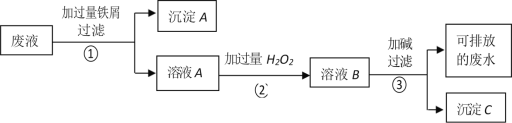
A. 沉淀 A 中含有 2 种金属单质
B. 可用 KSCN 溶液来检验溶液 B 中所含的金属离子
C. 溶液 A 若只经过操作③最终将无法得到沉淀 C
D. 操作①②③中都需要用到玻璃棒、漏斗
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在密闭容器中进行如下反应: X2(g)+Y 2(g) ![]() 2Z(g) ,已知 X 2、Y2、Z 的起始浓度分别为0.1mol/L 、0.3mol/L 、0.2mol/L ,在一定条件下,当反应达到平衡时,各物质的浓度有可能是 ( )
2Z(g) ,已知 X 2、Y2、Z 的起始浓度分别为0.1mol/L 、0.3mol/L 、0.2mol/L ,在一定条件下,当反应达到平衡时,各物质的浓度有可能是 ( )
A.Z 为 0.3mol/LB.Y2 为 0.4mol/LC.X2 为 0.2mol/LD.Z 为 0.4mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下向一定浓度的Na2X溶液中滴入盐酸,粒子浓度与混合溶液的pH变化的关系如图所示,已知:H2X是二元弱酸,Y表示![]() 或
或![]() ,pY=-lgY。下列叙述错误的是
,pY=-lgY。下列叙述错误的是

A.曲线n表示![]() 与pH的变化关系
与pH的变化关系
B.Ka1(H2X)=1.0×10-10.3
C.NaHX溶液中c(OH-)>c(H+)
D.当pH=7时,混合溶液中c(Na+)=c(HX-)+2c(X2-)+c(Cl-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学反应A2(g)+B2(g)===2AB(g)的能量变化如图所示。下列有关叙述正确的是
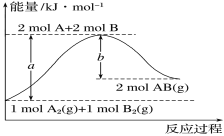
A.每生成2molAB(g)吸收bkJ热量
B.断裂1molA—A键和1molB—B键,放出akJ能量
C.该反应中反应物的总能量高于生成物的总能量
D.反应热ΔH=+(a-b)kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA表示阿伏加德罗常数,下列说法正确的是
A. 1 mol氦气中有2NA个氦原子
B. 2 L 0.3 mol·L-1Na2SO4溶液中含0.6NA个Na+
C. 14 g氮气中含NA个氮原子
D. 18 g水中所含的电子数为8NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,NaCN溶液中CN-、HCN浓度所占分数(δ)随pH变化的关系如图甲所示。向10mL0.01mol·L-1NaCN溶液中逐滴加入0.01mol·L-1的盐酸,其pH变化曲线如图乙所示[其中a点的坐标为(9.5,0.5)]。下列溶液中的关系中正确的是( )
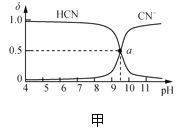
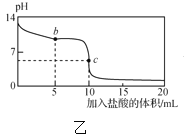
A.常温下,HCN的电离平衡常数:Ka(HCN)=10-4.5
B.图甲中pH=7的溶液:c(Cl-)=c(HCN)
C.图乙中b点的溶液:c(CN-)>c(Cl-)>c(HCN)>c(OH-)>c(H+)
D.图乙中c点的溶液:c(Na+)+c(H+)=c(HCN)+c(OH-)+c(CN-)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com