
| 试剂组合 | ①Ca(OH)2 NH4Cl | ②Ca(OH)2(NH4)2SO4 | ③CaO NH4Cl | ④CaO(NH4)2SO4 |
| NH3体积( mL) | 1344 | 1364 | 1792 | 1753 |
| 实际产量 |
| 理论产物 |
| 5.4g |
| 53.5g/mol |
| 5.4g |
| 132g/mol |
| 实际产量 |
| 理论产物 |
| ||
| ||
| 5.4g |
| 53.5g/mol |
| 5.4g |
| 132g/mol |
| 实际产量 |
| 理论产物 |
| ||
| 0.1mol |
| ||
| 0.08mol |
| ||
| 0.1mol |
| ||
| 0.08mol |


科目:高中化学 来源: 题型:
| A、CuO、Fe、ZnCl2 |
| B、SO2、Fe、HNO3 |
| C、CaO、C、BaCO3 |
| D、SO2、S、NaNO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
 纳米碳酸钙广泛应用于橡胶、塑料、造纸、化学建材、油墨、涂料、密封胶与胶粘剂等行业.在浓CaCl2溶液中通入NH3和CO2,可以制得纳米级碳酸钙.某校学生实验小组设计如图1所示装置,制取该产品.D中装有蘸稀硫酸的脱脂棉,图中夹持装置已略去.
纳米碳酸钙广泛应用于橡胶、塑料、造纸、化学建材、油墨、涂料、密封胶与胶粘剂等行业.在浓CaCl2溶液中通入NH3和CO2,可以制得纳米级碳酸钙.某校学生实验小组设计如图1所示装置,制取该产品.D中装有蘸稀硫酸的脱脂棉,图中夹持装置已略去.查看答案和解析>>
科目:高中化学 来源: 题型:
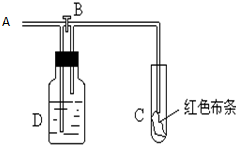 如图:A处通入氯气.关闭B阀时,C处红色布条无变化,打开B阀时,C处红色布条褪色.由此作出的判断正确的是( )
如图:A处通入氯气.关闭B阀时,C处红色布条无变化,打开B阀时,C处红色布条褪色.由此作出的判断正确的是( )| A、D中可能是浓硫酸 |
| B、通入的氯气含有水蒸气 |
| C、D中可能是水 |
| D、D中不可能是NaOH溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:
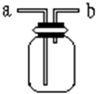 如图所示是中学化学实验中常见的装置,它有多种用途.
如图所示是中学化学实验中常见的装置,它有多种用途.查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com