
����Ŀ���ϳɰ������Ĵ����������˹��̵�����Ҫ;�������о�������ȷ������ָ�����ϳɰ���Ӧ��ƽ�ⳣ��Kֵ���¶ȵĹ�ϵ�����
�� �ȣ��棩 | 360 | 440 | 520 |
Kֵ | 0.036 | 0.010 | 0.0038 |
��1�������ϱ����ݿ�֪�÷�ӦΪ_____ ������ȣ����ȣ���ȷ��������Ӧ��
�����д�ʩ������������ԭ��������_____������ţ���
a������ѹǿ�����ںϳɰ� b��ʹ�ú��ʵĴ��������ڿ������ɰ�
c����������Ҫ�����¶���500��C���� d����Ҫʹ�ù�����N2�����H2ת����
��2��0.2mol��������ˮ�����뺬��0.2mol�������Һ��Ӧ����QkJ���������Ȼ�ѧ����ʽ��ʾ�䷴Ӧʽ_____��
��3������ʱ����amol��������ˮ����ͨ��bmol�Ȼ��⣬��Һ���Ϊ1L����c��NH4+��=c��Cl��������һˮ�ϰ��ĵ���ƽ�ⳣ��Kb=_____����ab��ʾ����
��4��ԭ����H2��ͨ����Ӧ CH4��g��+H2O ��g��![]() CO��g��+3H2��g�� ��ȡ����֪�÷�Ӧ�У�����ʼ������е�
CO��g��+3H2��g�� ��ȡ����֪�÷�Ӧ�У�����ʼ������е�![]() �㶨ʱ���¶ȡ�ѹǿ��ƽ������CH4������Ӱ����ͼ��ʾ��
�㶨ʱ���¶ȡ�ѹǿ��ƽ������CH4������Ӱ����ͼ��ʾ��
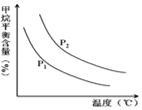
��ͼ�У��������߱�ʾѹǿ�Ĺ�ϵ�ǣ�P1_____P2�����������=����������
����������һ���������¶ȣ������IJ��ʻ�__�����������С����С�������䡱���䣩��
��5��ԭ����H2����ͨ����ӦCO��g��+H2O��g��![]() CO2��g��+H2��g����ȡ��
CO2��g��+H2��g����ȡ��
��T��ʱ�����ݻ��̶�Ϊ5L�������г���1molˮ������1mol CO����Ӧ��ƽ����CO��Ũ��Ϊ0.08molL��1�����¶��·�Ӧ��ƽ�ⳣ��KֵΪ_____��
�ڱ����¶���ΪT�����ݻ����Ϊ5L���ı�ˮ������CO�ij�ʼ���ʵ���֮�ȣ������������з�Ӧ�����������ܹ�˵����ϵ����ƽ��״̬����_____������ţ���
a��������ѹǿ����ʱ��ı�
b�����������ܶȲ���ʱ��ı�
c����λʱ��������a mol CO2��ͬʱ����a mol H2
d���������n��CO����n��H2O����n��CO2����n��H2��=1��16��6��6
���𰸡� ���� ad NH3��H2O��aq��+H2SO4��aq��=NH4HSO4��aq��+H2O��l����H=��5Q kJmol��1 ![]() �� ���� 2.25 cd
�� ���� 2.25 cd
����������1�����⿼�黯ѧƽ�ⳣ������������ԭ��������ѧƽ�ⳣ��ֻ���¶ȵ�Ӱ�죬���ݱ������ݣ������¶ȵ����ߣ���ѧƽ�ⳣ�����ͣ�˵������Ӧ�����Ƿ��ȷ�Ӧ������������ԭ���Ǵﵽƽ�⣬�ı�ijһ���أ�ƽ����������һ���صķ����ƶ����ϳɰ�N2(g)��3H2(g) ![]() 2NH3(g)��a����ֶ������壬��Ӧǰ����ϵ��֮�ʹ��ڷ�Ӧ������ϵ��������ѹǿ��ƽ��������Ӧ��Ӧ�����ƶ���������������ԭ��������ȷ��b�������Ի�ѧƽ����Ӱ�죬��������������ԭ�����ʴ���c���ϳɰ��Ƿ��ȷ�Ӧ�������¶����淴Ӧ������У��¶ȿ�����500�����ң�ʹ�����Ĵ�Ч�ʴﵽ���������������ԭ�����ʴ���d������������ƽ��������Ӧ������У�������ת������������������ԭ��������ȷ����2�������Ȼ�ѧ��Ӧ����ʽ����д��ע����Ȼ�ѧ��Ӧ����ʽ��д��Ҫ�����֣����ߵ����ʵ�����ȣ����ɵ���NH4HSO4������1molNH3ʱ����������ΪQ/0.2kJ=5QkJ��ע���ǰ�����ˮ��Һ������Ȼ�ѧ��Ӧ����ʽΪ��NH3��H2O��aq��+H2SO4��aq��= NH4HSO4��aq��+H2O��l����H=-5Q kJ��mol��1����3�����⿼�����ƽ�ⳣ���ı���ʽ������c(NH4��)=c(Cl��)��Ӧ�ӵ���غ����֣���c(NH4��)��c(H��)=c(OH��)��c(Cl��)����Ϊc(NH4��)=c(Cl��)��������Һ�����ԣ�Kb=c(NH4��)��c(OH��)/c(NH3��H2O)��c(NH4��)=c(Cl��)=b/1mol��L��1=bmol��L��1�����ݵ�Ԫ���غ㣬���c(NH3��H2O)=(a��b)/1mol��L��1=(a��b)mol��L��1��������������ʽKb=��b ��10��7��/( a- b)����4�����⿼����������ԭ�������������ߣ���Ӧǰ����ϵ��֮��С�ڷ�Ӧ������ϵ��֮�ͣ�����ѹǿ��ƽ�����淴Ӧ�����ƶ�������ĺ�������P1<P2���ڸ����ߵ����������¶����ߣ����������������ͣ�˵��ƽ��������Ӧ������У�������Ӧ���������ȷ�Ӧ�������¶ȣ������IJ�������5�����⿼�黯ѧƽ�ⳣ���ļ��㡢��ѧƽ��״̬���жϣ���CO(g) + H2O(g)
2NH3(g)��a����ֶ������壬��Ӧǰ����ϵ��֮�ʹ��ڷ�Ӧ������ϵ��������ѹǿ��ƽ��������Ӧ��Ӧ�����ƶ���������������ԭ��������ȷ��b�������Ի�ѧƽ����Ӱ�죬��������������ԭ�����ʴ���c���ϳɰ��Ƿ��ȷ�Ӧ�������¶����淴Ӧ������У��¶ȿ�����500�����ң�ʹ�����Ĵ�Ч�ʴﵽ���������������ԭ�����ʴ���d������������ƽ��������Ӧ������У�������ת������������������ԭ��������ȷ����2�������Ȼ�ѧ��Ӧ����ʽ����д��ע����Ȼ�ѧ��Ӧ����ʽ��д��Ҫ�����֣����ߵ����ʵ�����ȣ����ɵ���NH4HSO4������1molNH3ʱ����������ΪQ/0.2kJ=5QkJ��ע���ǰ�����ˮ��Һ������Ȼ�ѧ��Ӧ����ʽΪ��NH3��H2O��aq��+H2SO4��aq��= NH4HSO4��aq��+H2O��l����H=-5Q kJ��mol��1����3�����⿼�����ƽ�ⳣ���ı���ʽ������c(NH4��)=c(Cl��)��Ӧ�ӵ���غ����֣���c(NH4��)��c(H��)=c(OH��)��c(Cl��)����Ϊc(NH4��)=c(Cl��)��������Һ�����ԣ�Kb=c(NH4��)��c(OH��)/c(NH3��H2O)��c(NH4��)=c(Cl��)=b/1mol��L��1=bmol��L��1�����ݵ�Ԫ���غ㣬���c(NH3��H2O)=(a��b)/1mol��L��1=(a��b)mol��L��1��������������ʽKb=��b ��10��7��/( a- b)����4�����⿼����������ԭ�������������ߣ���Ӧǰ����ϵ��֮��С�ڷ�Ӧ������ϵ��֮�ͣ�����ѹǿ��ƽ�����淴Ӧ�����ƶ�������ĺ�������P1<P2���ڸ����ߵ����������¶����ߣ����������������ͣ�˵��ƽ��������Ӧ������У�������Ӧ���������ȷ�Ӧ�������¶ȣ������IJ�������5�����⿼�黯ѧƽ�ⳣ���ļ��㡢��ѧƽ��״̬���жϣ���CO(g) + H2O(g) ![]() CO2 (g) + H2(g)
CO2 (g) + H2(g)
��ʼ��mol��L��1�� 0.2 0.2 0 0
�仯 0.12 0.12 0.12 0.12
ƽ�� 0.08 0.08 0.12 0.12 ���ݻ�ѧƽ�ⳣ�����壬�����ʽΪK=c(H2)��c(CO2)/[c(CO)��c(H2O)]=0.122/0.082=2.25��a����Ϊ��Ӧǰ������ϵ��֮����ȣ�ѹǿ���䣬����˵����Ӧ�ﵽƽ�⣬�ʴ���b����ֶ������壬��������������䣬�����Ǻ㶨�������ܶȵĶ��壬�ܶȱ��ֲ��䣬����˵����Ӧ�ﵽƽ�⣬�ʴ���c���ò�ͬ���ʵķ�Ӧ���ʱ�ʾ�ﵽƽ�⣬Ҫ��Ӧ����һ��һ�棬�ҷ�Ӧ����֮�ȵ��ڻ�ѧ������֮�ȣ�����������˵����Ӧ������Ӧ������У�����CO2��˵����Ӧ���淴Ӧ������У��ҵ��ڻ�ѧ������֮�ȣ���Ӧ�ﵽƽ�⣬����ȷ��d������Ũ���̽��м��㣬��ʱ��Ũ����Ϊ6��6/(16��1)=2.25�����ڻ�ѧƽ�ⳣ����˵����Ӧ�ﵽƽ�⣬����ȷ��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����������[(NH4)2Fe(SO4)2]�Ƿ�����ѧ�е���Ҫ�Լ���
[��������]��������������500��ʱ�������������ȫ�ֽ⣬�ֽ�����к�����������������������ˮ�����ȡ�
[ʵ��̽��]ij��ѧС��ѡ����ͼ��ʾ����װ�ý���ʵ��(�г�װ����)
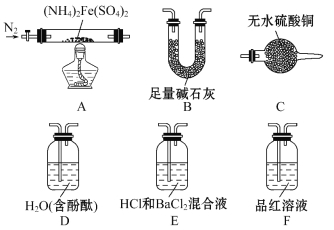
ʵ��� ��֤�ֽ�����к��а�����ˮ��������̽����������ɷ֡�
(1)��ѡ��װ�õ���ȷ����˳��Ϊ_______(��װ�õ���ĸ���)��
(2)֤����ˮ�������ɵ�ʵ������Ϊ___________________________________��
(3)֤���а������ɵ�ʵ������Ϊ_____________________________________��
(4)A�й�����ȫ�ֽ���Ϊ����ɫ��ĩ�����ʵ��֤��A�в��������ΪFe2O3��������FeO��Fe3O4��_______________________��
ʵ��� ��ͬѧΪ̽���ֽ�����е������������װ��A-E-F-B����ʵ�顣
(5)ʵ������й۲쵽��E��û����������F����Һ��ɫ���ݴ˵ó��Ľ�����_________________________________��
(6)B��������_____________________________________��
(7)ʵ��֤��(NH4)2Fe(SO4)2���ȷֽ�����������⣬����N2���ɣ�д��A�з�Ӧ�Ļ�ѧ����ʽ___________________________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����V��W��X��Y��Z����Ԫ�أ����ǵ�ԭ���������������Ҷ�С��20;����X��Z�ǽ���Ԫ�ء���֪V��Z��ͬһ�壬����ԭ��������Ӳ���ֻ��1������,W��YҲ��ͬһ�壬Wԭ��������Ӳ��ϵ������Ǵ�����Ӳ��ϵ�������3��,Xԭ��������Ӳ��ϵ���������Yԭ��������Ӳ��ϵ�������һ�롣������ص�Ԫ�ط��Żش�
��1��X��Z���Ե�����������Ӧ��ˮ������Է�Ӧ���κ�ˮ���÷�Ӧ�����ӷ���ʽΪ_____________��
��2��X����������Ӧ��ˮ������ˮ�е��뷽��ʽΪ��____________________________________��
��3��W��Z ���γɻ�����Z2W2���û�����ĵ���ʽΪ ______________________________________��
��4��Y��Z�γɵĻ�����ˮ��ҺpH ______ 7����������������������������ӷ���ʽ��ʾ��ԭ�� ____________________________________________________________��
��5����״���£�Y�����������Ϊ��ɫ���壬��������0.20 mol��������һ����Һ̬ˮ��ϵõ�һ��ϡ��Һ�����ų�Q kJ��������д���÷�Ӧ���Ȼ�ѧ����ʽ��________________________________��
��6��W��V ���γɻ�����V2W2���û�����ĽṹʽΪ ______________________________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����и������ӣ�����ɫ��ǿ������Һ���ܴ���������ǣ�������
A.Mg2+��K+��SO42����CO32��
B.Na+��NO3����Ac����K+
C.Al3+��Na+��Cl����SO42��
D.Na+��K+��MnO4����Cl��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪�л�������Aֻ��̼��������Ԫ���������ʹ��ˮ��ɫ�������������������һ������ʯ�ͻ����ķ�չˮƽ��A��B��C��D��E�����¹�ϵ��
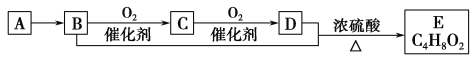
�������ƶϲ���ȷ����( )
A������A�ͼ����ѡ�����Ը��������Һ
B��D�к��еĹ�����Ϊ�Ȼ�������D���ʿ������ˮ���е�ˮ��
C������C�Ľṹ��ʽΪCH3CHO��E������Ϊ��������
D��B��D��E�Ļ�ѧ����ʽΪCH3CH2OH��CH3COOHCH3COOC2H5
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����һ�������۷����Ȼ�����Һ�У���ȫ��Ӧ��������Һ��Fe2+��Fe3+�����ʵ���Ũ��֮��Ϊ1��2�����ѷ�Ӧ��Fe3+��δ��Ӧ��Fe3+�����ʵ���֮��Ϊ��������
A.1��1
B.1��2
C.1��3
D.2��3
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������������,���ܺ���ϩ�����ӳɷ�Ӧ����( )��
A. H2 B. H2O C. KMnO4 D. Br2
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������˵������ȷ����
A�����ֽⷴӦһ������������ԭ��Ӧ
B���û���Ӧһ����������ԭ��Ӧ
C���е��ʲμӵķ�Ӧһ����������ԭ��Ӧ
D���е������ɵķֽⷴӦһ����������ԭ��Ӧ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪��Ӧ��NaH+H2O=H2+NaOH���Ը÷�Ӧ���ж���ȷ���ǣ�������
A.1mol NaH�μӷ�Ӧʧȥ1mol����
B.ÿ����1mol H2ת��2mol����
C.NaH���������������ǻ�ԭ��
D.NaOH����������
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com