
CŗĶCuOŌŚŅ»¶ØĪĀ¶ČĻĀ·“Ó¦£¬²śĪļÓŠCu”¢Cu2O”¢CO”¢CO2”£Čō½«2.00 g Cøś16.0 g CuO»ģŗĻ£¬øō¾ųæÕĘų¼ÓČČ£¬½«Éś³ÉµÄĘųĢåČ«²æĶعż×ćĮæµÄ³ĪĒåŹÆ»ŅĖ®£¬·“Ó¦Ņ»¶ĪŹ±¼äŗó¹²ŹÕ¼Æµ½1.12 LĘųĢå£Ø±ź×¼×“æö£©£¬Éś³É³ĮµķµÄÖŹĮæĪŖ5.00 g”£ĻĀĮŠĖµ·Ø“ķĪóµÄŹĒ£Ø £©
A£®·“Ó¦ŗóµÄ¹ĢĢå»ģŗĻĪļÖŠCuµÄÖŹĮæĪŖ12.8 g
B£®·“Ó¦ŗóµÄ¹ĢĢå»ģŗĻĪļÖŠ»¹ŗ¬ÓŠĢ¼
C£®·“Ó¦ŗóµÄ¹ĢĢå»ģŗĻĪļ×ÜÖŹĮæĪŖ13.6 g
D£®·“Ó¦ŗóµÄ¹ĢĢå»ģŗĻĪļÖŠŃõ»ÆĪļµÄĪļÖŹµÄĮæĪŖ0.05mol
A
”¾½āĪö”æ
ŹŌĢā·ÖĪö£ŗn(CuO)=16g”Ā80g/mol=0.2mol;øł¾ŻĢāŅāæÉÖŖ£ŗn(CO2)=n(CaCO3)= 5.00g”Ā100g/mol= 0.05 mol ,n(CO)=1.12L”Ā22.4L/mol =0.05mol,øł¾ŻĢāŅāæɵƷ½³ĢŹ½£ŗ2C + 4CuO  2Cu +Cu2O + CO”ü+CO2”ün(Cu)=0.1mol£¬ĖłŅŌm(Cu)= 6.4 g£¬Ń”ĻīA“ķĪó£»·“Ó¦ĻūŗÄĢ¼µÄĪļÖŹµÄĮæŹĒn(CO2)+ n(CO)=0.1mol,ĘäÖŹĮæŹĒ0.1mol”Į12g/mol=1.2g<2g”£ĖłŅŌ·“Ó¦ŗóµÄ¹ĢĢå»ģŗĻĪļÖŠ»¹ŗ¬ÓŠ¹żĮæµÄĢ¼£¬Ń”ĻīBÕżČ·£»·“Ó¦ŗóµÄ¹ĢĢå»ģŗĻĪļ×ÜÖŹĮæĪŖŌ¹ĢĢåµÄÖŹĮæ¼õČ„²śÉśµÄCO2”¢COµÄÖŹĮæŗĶ£¬m(¹ĢĢå)=(2.00g+16.0g)£0.05mol”Į44g/mol£0.05mol”Į28g/mol=13.6 g,Ń”ĻīCÕżČ·£»øł¾ŻOŌŖĖŲŹŲŗćæɵƷ“Ó¦ŗóµÄ¹ĢĢå»ģŗĻĪļÖŠŃõ»ÆĪļCu2OµÄĪļÖŹµÄĮæĪŖn(CuO)£2 n(CO2)£n(CO)=0.2mol£0.15mol=0.05mol,ÕżČ·”£
2Cu +Cu2O + CO”ü+CO2”ün(Cu)=0.1mol£¬ĖłŅŌm(Cu)= 6.4 g£¬Ń”ĻīA“ķĪó£»·“Ó¦ĻūŗÄĢ¼µÄĪļÖŹµÄĮæŹĒn(CO2)+ n(CO)=0.1mol,ĘäÖŹĮæŹĒ0.1mol”Į12g/mol=1.2g<2g”£ĖłŅŌ·“Ó¦ŗóµÄ¹ĢĢå»ģŗĻĪļÖŠ»¹ŗ¬ÓŠ¹żĮæµÄĢ¼£¬Ń”ĻīBÕżČ·£»·“Ó¦ŗóµÄ¹ĢĢå»ģŗĻĪļ×ÜÖŹĮæĪŖŌ¹ĢĢåµÄÖŹĮæ¼õČ„²śÉśµÄCO2”¢COµÄÖŹĮæŗĶ£¬m(¹ĢĢå)=(2.00g+16.0g)£0.05mol”Į44g/mol£0.05mol”Į28g/mol=13.6 g,Ń”ĻīCÕżČ·£»øł¾ŻOŌŖĖŲŹŲŗćæɵƷ“Ó¦ŗóµÄ¹ĢĢå»ģŗĻĪļÖŠŃõ»ÆĪļCu2OµÄĪļÖŹµÄĮæĪŖn(CuO)£2 n(CO2)£n(CO)=0.2mol£0.15mol=0.05mol,ÕżČ·”£
æ¼µć£ŗæ¼²éŃõ»Æ»¹ŌµÄ¼ĘĖćµÄÓŠ¹ŲÖŖŹ¶”£


 æŚĖćŠÄĖćĖŁĖćÓ¦ÓĆĢāĻµĮŠ“š°ø
æŚĖćŠÄĖćĖŁĖćÓ¦ÓĆĢāĻµĮŠ“š°ø Ķ¬²½ĶŲÕ¹ŌĶĮĻµĮŠ“š°ø
Ķ¬²½ĶŲÕ¹ŌĶĮĻµĮŠ“š°ø
| Äź¼¶ | øßÖŠæĪ³Ģ | Äź¼¶ | ³õÖŠæĪ³Ģ |
| øßŅ» | øßŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” | ³õŅ» | ³õŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” |
| ø߶ž | ø߶žĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õ¶ž | ³õ¶žĆā·ŃæĪ³ĢĶĘ¼ö£” |
| øßČż | øßČżĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õČż | ³õČżĆā·ŃæĪ³ĢĶĘ¼ö£” |
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ2015½ģɽ¶«Ź”øßČżÉĻѧʌµŚ¶ž“ĪŌĀæ¼ĮŖæ¼»ÆѧŹŌ¾ķ£Ø½āĪö°ę£© ĢāŠĶ£ŗŃ”ŌńĢā
ĻĀĮŠĶʶĻÕżČ·µÄŹĒ
A£®SiO2 ŹĒĖįŠŌŃõ»ÆĪļ£¬ÄÜÓėNaOHČÜŅŗ·“Ó¦
B£®Na2O”¢Na2O2×é³ÉŌŖĖŲĻąĶ¬£¬Óė CO2·“Ó¦²śĪļŅ²ĻąĶ¬
C£®CO”¢NO”¢ NO2¶¼ŹĒ“óĘųĪŪČ¾ĘųĢ壬ŌŚæÕĘųÖŠ¶¼ÄÜĪČ¶Ø“ęŌŚ
D£®ŠĀÖĘĀČĖ®ĻŌĖįŠŌ£¬ĻņĘäÖŠµĪ¼ÓÉŁĮæ×ĻÉ«ŹÆČļŹŌŅŗ£¬³ä·ÖÕńµ“ŗóČÜŅŗ³ŹŗģÉ«
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ2015½ģɽ¶«Ź”ŗŹŌóŹŠøßČżÉĻѧʌʌ֊ĮŖæ¼»ÆѧŹŌ¾ķ£ØA£©£Ø½āĪö°ę£© ĢāŠĶ£ŗŃ”ŌńĢā
ŅŃÖŖI£”¢Fe2+”¢SO2”¢Cl£ŗĶH2O2¾łÓŠ»¹ŌŠŌ£¬ĖüĆĒŌŚĖįŠŌČÜŅŗÖŠ»¹ŌŠŌŹĒĖ³ŠņĪŖSO2 > I£ > Fe2+ > H2O2> Cl£,ŌņĻĀĮŠ·“Ó¦²»æÉÄÜ·¢ÉśµÄŹĒ
A£®2Fe2++Cl2=2Fe3++2Cl£
B£®2Fe3++SO2+2H2O£½2Fe2++SO42£+4H+
C£®H2O2+H2SO4=SO2”ü+O2”ü+2H2O
D£®SO2+I2+2H2O£½H2SO4+2HI
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ2015½ģɽ¶«Ź”øßČżÉĻѧʌµŚŅ»“ĪÖŹĮæ¼ģ²ā»ÆѧŹŌ¾ķ£Ø½āĪö°ę£© ĢāŠĶ£ŗŃ”ŌńĢā
ĻĀĮŠĖµ·ØÕżČ·µÄŹĒ£Ø £©
A£®HClOÖŠĀČŌŖĖŲ»ÆŗĻ¼Ū±ČHClO4ÖŠĀČŌŖĖŲ»ÆŗĻ¼ŪµĶ£¬ĖłŅŌ£¬HClO4µÄŃõ»ÆŠŌĒæ
B£®ŅŃÖŖ¢ŁFe + Cu2+ = Fe2+ + Cu£»¢Ś 2Fe3+ + Cu = 2Fe2+ + Cu2+£¬ŌņŃõ»ÆŠŌĒæČõĖ³ŠņĪŖ£ŗFe3+ > Cu2£« > Fe2+
C£®ŅŃÖŖ»¹ŌŠŌ£ŗB£> C£> D££¬·“Ó¦ 2C£+ D2 = 2D£+C2ŗĶ·“Ó¦ 2C£+ B2 = 2B£+C2¶¼ÄÜ·¢Éś
D£®¾ßÓŠĒæŃõ»ÆŠŌŗĶĒ滹ŌŠŌµÄĪļÖŹ·ÅŌŚŅ»Ęš¾ĶÄÜ·¢ÉśŃõ»Æ»¹Ō·“Ó¦
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ2015½ģɽ¶«Ź”øßČżÉĻѧʌµŚŅ»“ĪÖŹĮæ¼ģ²ā»ÆѧŹŌ¾ķ£Ø½āĪö°ę£© ĢāŠĶ£ŗŃ”ŌńĢā
ĻĀĮŠ¶Ō»ÆѧÖŖŹ¶øÅĄØŗĻĄķµÄŹĒ( )
A£®ĖįŠŌŃõ»ÆĪļ¶¼ŹĒ·Ē½šŹōŃõ»ÆĪļ
B£®Ņ»ÖÖŌŖĖŲæÉÄÜÓŠ¶ąÖÖŃõ»ÆĪļ£¬µ«Ķ¬ÖÖ»ÆŗĻ¼ŪÖ»¶ŌÓ¦Ņ»ÖÖŃõ»ÆĪļ
C£®¶”“ļ¶ūŠ§Ó¦æÉÓĆÓŚĒų±šČÜŅŗÓė½ŗĢ壬ŌĘ”¢Īķ¾łÄܲśÉś¶”“ļ¶ūŠ§Ó¦
D£®ČŪȌדĢ¬Äܵ¼µēµÄĪļÖŹŅ»¶ØŹĒĄė×Ó»ÆŗĻĪļ
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ2015½ģɽ¶«Ź”ĮijĒŹŠøßČżÉĻѧʌµŚŅ»“Ī½×¶ĪŠŌ²āŹŌ»ÆѧŹŌ¾ķ£Ø½āĪö°ę£© ĢāŠĶ£ŗŃ”ŌńĢā
ŌŚøų¶ØĢõ¼žĻĀ£¬ĻĀĮŠ¼ÓµćµÄĪļÖŹŌŚ»Æѧ·“Ó¦ÖŠĶźČ«ĻūŗĵďĒ£Ø £©
A£®ÓĆ50mL 12 mol”¤L£1µÄĀČ»ÆĒāĖ®ČÜŅŗÓė×ćĮ涞Ńõ»ÆĆĢ¹²ČČÖĘČ”ĀČĘų
B£®½«1gĀĮʬĶ¶Čė20mL 18.4 mol”¤L£1µÄĮņĖįÖŠ
C£®Ļņ100mL 3 mol”¤L£1µÄĻõĖįÖŠ¼ÓČė5.6gĢś
D£®³£ĪĀ³£Ń¹ĻĀ£¬0.1molĀČĘųĶØČė1LĖ®ÖŠ·“Ó¦
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ2015½ģɽ¶«Ź”ĮijĒŹŠøßČżÉĻѧʌµŚŅ»“Ī½×¶ĪŠŌ²āŹŌ»ÆѧŹŌ¾ķ£Ø½āĪö°ę£© ĢāŠĶ£ŗŃ”ŌńĢā
³żČ„ĻĀĮŠĪļÖŹÖŠĖłŗ¬µÄŌÓÖŹ(ĄØŗÅÄŚĪŖŌÓÖŹ)£¬Ń”ÓĆŹŌ¼ĮÕżČ·µÄŹĒ£Ø £©
A£®Al2O3(SiO2)£ŗNaOHČÜŅŗ
B£®CO2(SO2):Na2CO3ČÜŅŗ
C£®FeCl2ČÜŅŗ(FeCl3)£ŗFe·Ū
D£®NaHCO3ČÜŅŗ£ØNa2CO3ČÜŅŗ£©£ŗCa(OH)2ČÜŅŗ
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ2015½ģɽ¶«Ź”ŃĢĢØŹŠøßČżÉĻŃ§ĘŚĘŚÖŠæ¼ŹŌ»ÆѧŹŌ¾ķ£Ø½āĪö°ę£© ĢāŠĶ£ŗŃ”ŌńĢā
µČĢå»żµČÅØ¶ČµÄĻ”ĻõĖįÓė¹żĮæµÄĻĀĮŠĪļÖŹ³ä·Ö·“Ó¦·Å³öNO£¬ĻūŗÄĻĀĮŠ¹ĢĢåµÄĪļÖŹµÄĮæ×īÉŁµÄŹĒ
A£®FeO B£®Fe C£®Cu D£®Ag
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ2015½ģɽ¶«Ź”Ī«·»ŹŠÖī³ĒøßČż10ŌĀŌĀæ¼»ÆѧŹŌ¾ķ£Ø½āĪö°ę£© ĢāŠĶ£ŗŃ”ŌńĢā
ŗ£ŃóÖŠÓŠ·įø»µÄŹ³Ę·”¢æó²ś”¢ÄÜŌ“ŗĶŅ©Īļ”£ĻĀĶ¼ŹĒ“Óŗ£Ė®ÖŠĢįČ”Ä³Š©ŌĮĻµÄĮ÷³ĢĶ¼”£
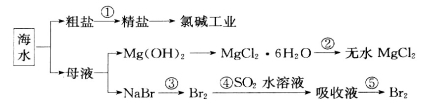
ĻĀĮŠÓŠ¹ŲĖµ·ØÕżČ·µÄŹĒ
A£®“Óŗ£Ė®ÖŠĢįČ”ĪļÖŹ¶¼±ŲŠėĶعż»Æѧ·“Ó¦²ÅÄÜŹµĻÖ
B£®µŚ¢Ś²½ŹōÓŚĪļĄķ±ä»Æ
C£®“ÓµŚ¢Ü”«¢Ż²½µÄÄæµÄŹĒÅØĖõ”¢ø»¼Æäåµ„ÖŹ
D£®µŚ¢Ł²½ÖŠ³żČ„“ÖŃĪÖŠµÄSO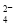 ”¢Ca2+”¢Mg2+”¢Fe3+µČŌÓÖŹ£¬¼ÓČėŹŌ¼ĮµÄĖ³ŠņĪŖ£ŗNa2CO3ČÜŅŗ”śNaOHČÜŅŗ”śBaCl2ČÜŅŗ”ś¹żĀĖŗó¼ÓŃĪĖį
”¢Ca2+”¢Mg2+”¢Fe3+µČŌÓÖŹ£¬¼ÓČėŹŌ¼ĮµÄĖ³ŠņĪŖ£ŗNa2CO3ČÜŅŗ”śNaOHČÜŅŗ”śBaCl2ČÜŅŗ”ś¹żĀĖŗó¼ÓŃĪĖį
µŚ¢ņ¾ķ(·ĒŃ”ŌńĢā£¬¹²55·Ö)
²éæ““š°øŗĶ½āĪö>>
°Ł¶ČÖĀŠÅ - Į·Ļ°²įĮŠ±ķ - ŹŌĢāĮŠ±ķ
ŗž±±Ź”»„ĮŖĶųĪ„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±ØĘ½ĢØ | ĶųÉĻÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | µēŠÅÕ©Ę¾Ł±Ø×ØĒų | É꥜Ź·ŠéĪŽÖ÷ŅåÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | ÉęĘóĒÖČؾŁ±Ø×ØĒų
Ī„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±Øµē»°£ŗ027-86699610 ¾Ł±ØÓŹĻä£ŗ58377363@163.com