
X、Y、Z、W是元素周期表中前30号元素,且原子序数依次增大。其相关信息如下表:
| 元素 | 相关信息 |
| X | X原子基态时最外层电子数是其内层电子总数的2倍 |
| Y | Y的基态原子最外层电子排布式为nsnnpn+2 |
| Z | Z元素的最高正价与负价代数和为6 |
| W | W基态原子未成对电子数是前30号元素中最多的 |
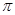 键数目为 。
键数目为 。(1)4 (1分) VIB(1分) 1 (1分)
(2)小(2分) 2NA(2分)
(3)H2O(2分) H2S(2分)
(4)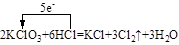 (3分)
(3分)
(5)C(s)+1/2O2=CO(g) ΔH=" -110.6" kJ?mol-1(2分)
解析试题分析:由Y的基态原子最外层电子排布式nsnnpn+2,可知Y为O;则由X原子基态时最外层电子数是其内层电子总数的2倍,可知X为C;Z元素的最高正价与负价代数和为6,可知Z为Cl;W基态原子未成对电子数是前30号元素中最多的,则W为Cr。
(1)Cr位于第4周期VIB族,最外层有1个电子。
(2)C的第一电离能比O小;C22-中含有1个碳碳三键,则1mol X22-中含有的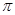 键数目为2NA。
键数目为2NA。
(3)因为O元素的非金属性大于C,所以X和Y的气态氢化物中,较稳定的是H2O;H2O分子间含有氢键,H2O的沸点最高,其它同族氢化物分子间为范德华力,随相对分子质量的增加而增大,所以最简单氢化物中沸点最低的是H2S。
(4)KClO3与HCl反应生成KCl、Cl2、H2O,配平可得化学方程式,根据化合价的变化,KClO3中Cl元素由+5价降低为0价,可标出电子转移的方向和数目。
(5)首先写出化学方程式并注明状态,然后根据盖斯定律,?H=ΔH 1-ΔH 2="-110.6" kJ?mol-1,进而写出热化学方程式。
考点:本题考查元素的推断、元素周期律和元素周期表、第一电离能的比较、化学键的判断、电子转移、热化学方程式的书写。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:填空题
X、Y、Z、M、Q是五种短周期主族元素,原子序数依次增大。 X、Y可形成最常用溶剂;X、Y、Z最夕层电子数之和为8;Y、M形成的气态化合物在标准状况下的密度为2.86g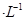 。请回答下列问题:
。请回答下列问题:
(1)Y、Z、M三种元素原子半径由小到大的顺序为(写元素符号)________________。
(2)Q在周期表中的位置是____________。
(3)X、Y、Q三种元素’形成的三原子分子结构式为______________;M、Q元素形成的最高价氧化物对应的水化物中较强的酸是(写化学式)_____________。
(4)Y与Z形成的化合物A既含离子键又含共价键,A的电子式为______________________;
将A加入盛有酚酞试液的试管中观察到的现象为_________________________________,发生反应的化学方程式为_________________。
(5)利用下列装置可将化合物MY2转化为重要化工原料H2MY4。电极a的催化剂表面发生的电极反应方程式为__________________________________;理论上通人MY2与O2的物质的量最佳比值为________________。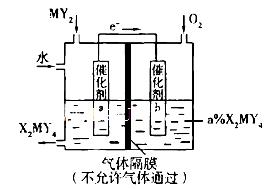
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
下表为元素周期表的一部分,请参照元素①~⑧在表中的位置,用化学用语回答下列问题: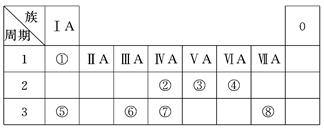
(1)④、⑤、⑥的原子半径由大到小的顺序是____________________________。
(2)②、③、⑦的最高价含氧酸的酸性由强到弱的顺序是______________________。
(3)①、④、⑤、⑧中的某些元素可形成既含离子键又含极性共价键的化合物,写出其中一种化合物的电子式:______________。
(4)写出由②、③、④中的元素形成的等电子体分子 。(任写一组)
(5)由表中两种元素的原子按1∶1组成的常见液态化合物的稀溶液易被催化分解,可使用的催化剂为(填序号)________。
a.MnO2 b.FeCl3 c.Na2SO3 d.KMnO4
(6)由表中①、③、④三种元素形成盐的水溶液呈酸性,用离子方程式表示其原因: ;由表中①、②、③、④四种元素形成的一种盐的水溶液呈中性,该盐的化学式是 。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
现有A、B、C、D、E、F六种短周期元素,它们的原子序数依次增大,A、D同主族,C与E同主族,D、E、F同周期,A、B的最外层电子数之和与C的最外层电子数相等,A能分别与B,C形成电子总数为10的分子,且A与C形成的化合物常温下为液态,A能分别与E、F形成电子总数为18的气体分子。请回答下列问题(题中的字母只代表元素代号,与实际元素符号无关);
(1)A~F六种元素原子,原子半径最大的是 (填元素符号),B元素在元素周期表中的位置 。
(2)D与E可形成化合物D2E,该化合物的电子式为 。
(3)A、C、E三种元素形成的一种常见化合物,其浓溶液在加热条件下可与碳反应,该反应的化学方程式为 ________________________________。
(4)比较E、F气态氢化物的稳定性: > (用分子式表示)。
(5)请写出:CH3OH和O2与KOH溶液组成的燃料电池总反应式: 。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
短周期主族元素A、B、C、D、E、F的原子序数依次递增,A、B两元素相邻,B、C、E原子的最外层电子数之和为13,C原子最外层电子数是E原子最外层电子数的3倍,B、F原子最外层电子数之和等于C、E原子最外层电子数之和。
请回答下列问题:
(1)B元素在元素周期表中的位置为____________ 。
(2)元素C和D可形成两种化合物D2C、D2C2,其中均含有的化学键类型是______________;元素E、F形成的最高价氧化物对应水化物的碱性强弱关系为_____>_____ (填化学式)。
(3)E的单质能与A的最高价氧化物发生置换反应,反应的化学方程式为_____________;
(4)F的单质加入到D的最高价氧化物对应水化物的溶液中,发生反应的离子方程式为______________.
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
A、B、M、D、E是原子序数依次增大的五种短周期元素。A元素的一种原子中不含中子。B、M、D、E分别在下表(周期表的一部分)不同的空格内占有相应的位置,E的原子序数是D的原子序数的2倍。试回答: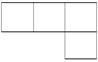
(1)A元素是________ 。
(2)在B、M、D、E四种元素的最简单氢化物中,沸点最高的是__________(填化学式)。
(3)A、B、M、D可组成多种18电子分子,写出 2种具有18电子的有机物的结构简式______、______。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
Q、R、X、Y、Z是原子序数依次增大的五种短周期元素,在短周期的所有元素中Q的原子半径与Z的原子半径之比最小(不包括稀有气体),R、X、Y三种元素的原子核外电子层数相同,同一周期中R的一种单质的熔点最高,Y与Q、R、X、Z均能形成多种常见化合物。
(1)X在周期表中的位置: ,其原子核外有 种不同形状的电子云。这五种元素中,最外层有两个未成对电子的元素是 (用元素符号表示)。
(2)常温下液态化合物甲只含上述元素中的两种,分子中原子个数比1︰1,甲的电子式是_______________。
(3)Q分别与X、Y形成的最简单化合物的稳定性______>______(用分子式表示)
(4)Q与R两元素可组成多种分子,其空间构型可能是 (填写序号)。
a.直线型 b.平面形 c.三角锥形 d.正四面体
(5)X的氧化物是形成光化学烟雾原因之一,工业上可采用它与其氢化物反应生成无毒害物质而除去,请用方程式表示该反应 。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
X、Y、Z、L、M、N是六种原子序数依次增大的前四周期元素。X、Y、Z、L是组成蛋白质的基础元素,M是地壳中含量最高的金属元素。N的核电荷数比L的核电荷数的3倍多2, 回答下列问题:
(1)X和Y可以形成10电子、14电子、18电子分子,写出X元素质子数和中子数相等的核素的符号 。由X和Y元素组成的14电子分子的电子式为 。
(2)在水溶液中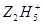 将Fe3+还原为Fe2+,
将Fe3+还原为Fe2+,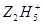 +4Fe3+→4Fe2++……其中化学反应式中的部分物质计量数已给出,该反应的离子方程式为______________________________。
+4Fe3+→4Fe2++……其中化学反应式中的部分物质计量数已给出,该反应的离子方程式为______________________________。
(3)一定条件下,M与TiO2、C(石墨)反应只生成M的氧化物和碳化钛(TiC),二者均为某些高温结构陶瓷的主要成分。已知。该反应生成lmol M的氧化物时放出536kJ的热量,其热化学方程式为 。
(4)Z元素的气态氢化物和最高价氧化物对应的水化物化合生成一种盐,该盐的水溶液呈 (填“酸”、“碱”或“中”)性,该水溶液中各离子浓度由小到大的顺序 。
(5)N的低价硫酸盐溶液与过氧化钠反应。若N的低价硫酸盐与过氧化钠的物质的量之比为2:1,且无气体生成,则该反应的离子方程式为 。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
下表是元素周期表的一部分, 针对表中的①~⑨种元素,填写下列空白:
| 族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 零 |
| 2 | | | | ① | ② | ③ | | |
| 3 | ④ | | | ⑤ | | | ⑥ | ⑦ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com