
【题目】依据氧化还原反应:2Ag+(aq)+Cu(s)=Cu2+(aq)+2Ag(s)设计的原电池如图所示。请回答下列问题:

(1)电极X的材料是______;电解质溶液Y是________。
(2)银电极为电池的______极,发生的电极反应式为_______________;X电极上发生的电极反应式为_________________。
(3)下图为直流电源电解稀Na2SO4水溶液的装置。通电后在石墨电极a和b附近分别滴加几滴石蕊溶液。则电极a为电解池的_______极,b电极附近出现的现象为______________。
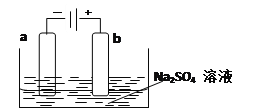
【答案】 Cu AgNO3溶液 正 2Ag++2e-===2Ag Cu-2e-===Cu2+ 阴 溶液呈红色
【解析】(1)硫酸铜溶液所在的电极是负极,所以电极X的材料是Cu;银电极是正极,则电解质溶液Y是AgNO3溶液。(2)银离子得到电子,银电极为电池的正极,发生的电极反应式为2Ag++2e-===2Ag;铜电极是负极,X电极上发生的电极反应式为Cu-2e-===Cu2+。(3)a电极与电源的负极相连,作阴极,溶液中的氢离子放电。b电极是阳极,溶液中的氢氧根放电,破坏水的电离平衡,氢离子浓度增大,即b电极周围溶液显酸性,滴加几滴石蕊溶液后b电极附近出现的现象为溶液呈红色。


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
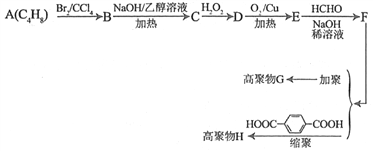
【题目】利用石油产品A(C4H8),可以合成材料化学重要的物质G和H。己知:
①A和C的核磁共振氢谱都有2组峰,且峰面积之比分别为1∶3和1∶2
②E和F都可发生银镜反应;E的分子式为:C4H4O2
③H2C=CH2+H2O2![]()
![]()
④R-CH2-CHO+HCHO![]()
![]()
G和H的合成路线如下图所示:
请回答下列问题:
(1)C的名称________________;F中官能团名称为____________________。
(2)A的同分异构体共有___________种(不包括A本身,不含立体异构)
(3)写出B到C的化学方程式和反应类型:
化学方程式为______________________________________________,反应类型是___________。
(4)D→E的化学方程式为___________________________________________。
(5)H的结构简式为_______________________________________________,G的结构简式为____________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A.反应条件是加热的反应都是吸热反应
B.化学反应除了生成新的物质外,还伴随着能量的变化
C.物质燃烧不一定是放热反应
D.放热的化学反应不需要加热就能发生
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A. 丙烯分子中所有原子均在同一平面上
B. ![]() 命名为2-甲基-3-丁炔
命名为2-甲基-3-丁炔
C. 化合物![]() 不是苯的同系物
不是苯的同系物
D. C5H12的同分异构体数目与甲苯的一氯代物数目相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知温度T时水的离子积常数为KW,该温度下,将浓度为amol·L-1的一元酸HA与bmol·L-1的一元碱BOH等体积混合,可判定该溶液呈中性的依据是( )
A. a=b
B. 混合溶液的pH=7
C. 混合溶液中,c(H+)=![]() mol·L-1
mol·L-1
D. 混合溶液中c(H+)+c(B+)=c(OH-)+c(A-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知X、Y为有刺激性气味的气体,有以下转化关系,部分产物未标出。

试回答:
(1)写出下列物质的化学式
X________、 Y________ 、A________ 、B______、 C________。
(2) 反应①的化学方程式为____________________________,
反应②的离子方程式为_______________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)同温同压下,同体积的氨气(NH3)和硫化氢(H2S)气体的质量比为________。
(2)同温同压下,氨气和硫化氢气体的密度比为________。
(3)在标准状况下,0.01 mol某气体的质量为0.44 g,则该气体的密度为________g·L1(保留小数点后两位),该气体的相对分子质量为________。
(4)在标准状况下,14 g CO与2 g H2的混合气体体积为________L。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】水是生命之源,它与我们的生活密切相关。自来水厂常用高铁酸钠(Na2FeO4)改善水质。高铁酸钠具有很强的氧化性,是一种新型的绿色净水消毒剂,在工业上制备高铁酸钠的方法有多种。
(1)简述高铁酸钠用于杀菌消毒同时又起到净水作用的原理_________________________________________________________________________。
(2)干法制备高铁酸钠的反应原理如下:
2FeSO4+6Na2O2==aNa2FeO4+bM↑+2Na2O+2Na2SO4
①高铁酸钠中铁元素的化合价为________________。
②上述方程式中b=____。每生成1molM,该反应转移电子的物质的量为_____________mol。
(3)工业上可以通过次氯酸钠氧化法制备高铁酸钠,生产过程如下:
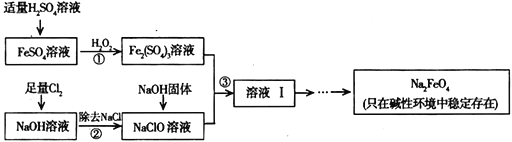
①步骤③中除生成Na2FeO4外,还有副产品Na2SO4、NaCl,则步骤③中反应的离子方程式为____________________________________。
②己知Na2FeO4在强碱性溶液中的溶解度较小。可向Na2FeO4溶液中继续加入氢氧化钠固体得到悬浊液。从Na2FeO4悬浊液得到固体的操作名称为_____________________。
(4)计算Na2FeO4的消毒效率(以单位质量得到的电子数表示)约是氯气的_______倍(结果保留两位小数。)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com